Introducción
La enfermedad renal crónica (ERC) representa un desafío significativo para la salud pública a nivel mundial, con una prevalencia en constante aumento y una carga considerable en términos de morbilidad y mortalidad (Argaiz et al., 2023). Las cifras de decesos en la actualidad son altas, debido a la baja concientización de la importancia de esta enfermedad y su detección a tiempo. En la Figura 1 se muestra el panorama mundial de muertes por enfermedad renal crónica, identificando hoy en día cantidades altas de defunciones (Hill et al., 2016). La figura presenta un mapa de tasa de mortalidad de la ERC, donde se puede observar por colores los países con mayor índice de mortalidad. Aquí se puede ver que ell continente africano presenta los más altos índices de mortalidad, seguido de Sudamérica y Norteamérica. En el caso de nuestro país, México presenta un color guinda, indicando un índice de mortalidad de entre 54.6 a 81.9 muertes por 100,000 habitantes, catalogándolo como uno de los diez países con mayor índice de padecimiento y mortalidad por ERC. Los continentes como Europa, Asia y Oceanía presentan países con un índice relativamente bajo de mortalidad entre 2.4 a 23.2 muertes por cada 100,000 habitantes. Esta visualización muestra la importancia y necesidad de generar el conocimiento y los tratamientos para atender la enfermedad renal crónica.
Figura 1
Mapa de calor de la tasa de mortalidad de la ERC en el mundo.
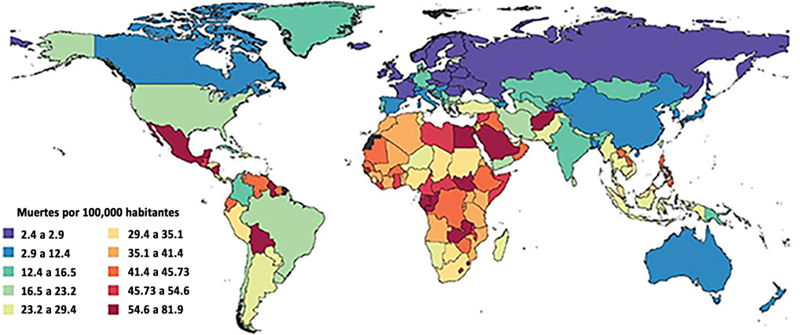
Fuente: Argaiz et al. (2023).
Uno de los aspectos clave en el manejo de esta enfermedad es la eliminación de toxinas urémicas que se acumulan en la sangre debido a la disminución de la función renal (Goicoechea, M., 2021; López, D., 2008). Estas toxinas pueden tener efectos adversos graves en la salud de los pacientes, contribuyendo a complicaciones como enfermedades cardiovasculares, neuropatías y trastornos metabólicos (Henao, V. C., 2010; Jha et al., 2013). La hemodiálisis es el tratamiento más común para eliminar estas toxinas urémicas, pero puede resultar insuficiente para retener un alto porcentaje de toxinas de bajo peso molecular como la urea, el ácido úrico y la creatinina (Levey et al., 2012; Malo et al., 2010; Ávila et al., 2013). Por lo tanto, actualmente existe una necesidad alarmante por desarrollar nuevos materiales para membranas de hemodiálisis que aumenten la eficacia de la eliminación de toxinas urémicas en pacientes con enfermedad renal crónica (K/DOQI, 2002; Webster et al., 2017).
En los últimos años, se ha investigado activamente el uso de nanomateriales para mejorar la eficacia de la eliminación de toxinas urémicas en pacientes con enfermedad renal crónica. Entre estos, los nanomateriales carbonosos y el óxido de silicio han emergido como candidatos prometedores debido a sus propiedades únicas, como alta área superficial, porosidad controlada y capacidad de adsorción selectiva (Rodríguez et al., 2021; Zhang et al., 2021). Estos materiales ofrecen la posibilidad de mejorar significativamente la eficacia de la remoción de toxinas urémicas en el proceso de hemodiálisis, al permitir una mayor eliminación de toxinas de bajo peso molecular, mejorando la calidad de vida y supervivencia de los pacientes (Li et al., 2017; Ronco et al., 2006).
El conocimiento de las investigaciones de nuevos materiales implementados para membranas de hemodiálisis es un tema de estudio con alta importancia en el ámbito de salud, fundamental para mejorar el tratamiento de esta enfermedad, así como para disminuir el impacto en la calidad de vida del paciente en el tratamiento de hemodiálisis.
La enfermedad renal crónica en la actualidad
Esta enfermedad presenta altas cifras de afectados, diversos estudios revelaron que alrededor de un 14% de la población mundial, es decir más de 1,100 millones de habitantes la presentan. México ocupa el noveno lugar a nivel mundial dentro de los países con mayor número de habitantes diagnosticados, es decir, más del 10% de la población mexicana entre 30 a 70 años presentan ERC (Martínez et al., 2021; World Kidney Day, 2023). A pesar de la alta frecuencia del padecimiento y del impacto clínico-económico de sus complicaciones, el nivel de conciencia sobre esta enfermedad sigue siendo notablemente bajo. A nivel mundial, solamente el 6% de la población tiene conocimiento general sobre la ERC, mientras que solo el 10% de la población diagnosticada está al tanto de su condición en etapas terminales (INEGI, 2022; Martínez et al., 2020; OMS, 2020).
Este padecimiento genera extrema preocupación al ocupar el séptimo lugar entre las diez principales causas de fallecimiento a la par del cáncer, cardiopatía isquémica, enfermedades pulmonares, según la organización mundial de la salud (Evans et al., 2022; INSP, 2020; Hill et al., 2016). La ERC es un trastorno irreversible y complejo de múltiples fases, pudiendo llegar hasta la muerte, consiste en la disfunción parcial o completa de los riñones, es decir, este padecimiento es generado a partir del daño progresivo de las nefronas en los riñones las cuales ocasionan la pérdida gradual de la tasa de filtración glomerular (TFG), generando la incorrecta filtración y mal desecho de productos metabólicos dañinos en la sangre (Gaitonde et al., 2017; Akchurin 2019). Esta enfermedad en etapas avanzadas o terminales solo puede ser atendida con dos opciones de tratamiento: un remplazo renal (TRS) mediante un trasplante, o un tratamiento sustituto como la diálisis peritoneal o hemodiálisis (Giraldo et al., 2023).
Las toxinas urémicas
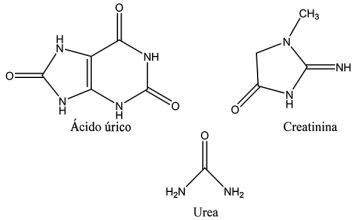
Las sustancias dañinas biológicas de tipo orgánicas almacenadas y retenidas en los fluidos corporales del ser humano son denominadas toxinas urémicas (Vanholder et al., 2003). Estas toxinas, incluyen urea, creatinina, ácido úrico y diversas moléculas nitrogenadas, y resultan principalmente de la descomposición de proteínas y el metabolismo celular normal (Liabeuf et al., 2010). En condiciones saludables, los riñones eliminan eficientemente estas toxinas del cuerpo, pero en la ERC, la capacidad de eliminación se ve comprometida, lo cual lleva a su acumulación en la sangre y tejidos (Duranton et al., 2012).
Estos compuestos tóxicos causan alteraciones en el cuerpo y son producidos en la flora intestinal como subproductos de actividades metabólicas de alimentos en el organismo. Existen más de 153 toxinas urémicas o subproductos en el organismo, estas están clasificadas en tres tipos: toxinas urémicas de bajo peso molecular, toxinas urémicas de peso molecular medio y toxinas urémicas ligadas a proteínas. Esta clasificación depende de sus características fisicoquímicas y pesos moleculares (Liabeuf et al., 2013; Evenepoel et al., 2009).
La acumulación de toxinas urémicas es dañina para el ser humano, cada tipo de toxina genera problemas de salud, algunos se mencionan a continuación (Padilla et al., 2017; Tagle 2016):
-
La retención de urea genera el trastorno del ciclo de urea denominado uremia, el cual produce un mal funcionamiento renal, así como nefrolitiasis úrica.
-
La nefrolitiasis úrica también conocida como cálculos renales es otra de las enfermedades generada a partir de la acumulación del ácido úrico. Esta toxina forma cristales en los riñones y vías urinarias, provocando alteraciones en el organismo y ocasionando este padecimiento. La nefrolitiasis es una afección urológica común que se incrementa con la edad tanto en hombres como en mujeres; no obstante, es más prevalente en varones jóvenes. La composición de los cálculos y su ubicación en el sistema urinario varían considerablemente según los niveles de ácido úrico en el organismo, la dieta del individuo y el pH de la orina.
-
La acumulación de ácido úrico produce hiperuricemia o la enfermedad llamada gota, ocasionando la inflamación en articulaciones hasta la artritis por la formulación de cristales en la sangre.
-
La creatinina en exceso bloquea las vías urinarias.
-
Desregulación de funciones endoteliales.
-
Daño directo en la comunicación de células por la pérdida de la barrera endotelial.
-
Daño cardiovascular y tisular por la respuesta inmunitaria.
Entre las principales toxinas urémicas determinantes en la remoción del tratamiento de hemodiálisis se encuentran la urea, la creatinina y el ácido úrico (Figura 2) debido a ser estas las principales toxinas más dañinas en grandes cantidades para el ser humano. Por lo anterior, es importante para el paciente tener una dieta equilibrada y reductora de la producción de toxinas en su organismo, así como también realizarse el tratamiento en tiempo y sin complicaciones.
El tratamiento de hemodiálisis
La mayoría de los pacientes comienza el tratamiento sustituto con hemodiálisis, debido en gran parte a la tardía detección de la enfermedad ocasionando el urgente y no planificado comienzo del tratamiento, debido a la poca o nula función de los riñones (Htay et al., 2021; Niang et al., 2018). Sin embargo, la diálisis peritoneal es otro de los tratamientos aplicado en etapas iniciales de la enfermedad (Andreoli et al., 2020). Actualmente, la elección de cualquiera de los tratamientos se basa en la disponibilidad, accesibilidad y elección del médico debido a la desigualdad mundial de acceso a los tratamientos especialmente en los entornos de bajos recursos (Shrestha, 2018).
La hemodiálisis es el tratamiento más infrautilizado, aplicado a más del 80% de los pacientes con ERC a nivel mundial. Este tratamiento debe ser aplicado de 2 a 3 veces por semana, con una duración promedio de 4 a 6 horas por sesión y un costo promedio de $4,000 a $5,000 pesos mexicanos por sesión. Este tratamiento consiste en un filtro de hemodiálisis con una eficiencia del 60% de retención de toxinas urémicas (DOF, 2022). Este equipo está conformado por un filtro o dializador de tipo capilar relleno de membranas semipermeables de diferentes materiales con un tamaño de poro promedio de 180-200 micras (Kotanko et al., 2010). La eficiencia de este sistema radica en el material con el cual están fabricadas las membranas para hemodiálisis, actualmente son elaboradas a partir de polímeros sintéticos como polisulfonas, poliacrilonitrilo, poliamidas, polietersulfona, entre otros (Ficheux et al., 2011). Siendo el de mayor comercialidad el filtro de polisulfona por su mejor procesabilidad y eficiencia en la remoción; sin embargo, estas membranas deben poseer diferentes características como: alto coeficiente de difusión, hidrofobicidad, alta área superficial de contacto, permeabilidad y biocompatibilidad (Guerreiro et al., 2023). Uno de los mayores problemas en las membranas para hemodiálisis es su bajo porcentaje de retención de toxinas urémicas, este problema es alarmante debido al desgaste físico y emocional en los pacientes y la afectación de su calidad de vida (Lythe et al., 2015; Saran et al., 2006).
La nanotecnología y las nanopartículas
La nanotecnología se ha convertido en una tecnología fundamental con aplicaciones en múltiples sectores debido a sus capacidades para manipular materiales a nivel atómico y molecular (Mosleh et al., 2022). Ha demostrado ser un avance crucial en diversas áreas de la ciencia y la tecnología debido a su importancia, la cual radica en la capacidad de crear materiales y dispositivos con propiedades mejoradas, con un impacto significativo en la medicina, la electrónica, los materiales, polímeros, cerámicos, entre otros campos (El-Khatib, 2012; Malik et al., 2023).
En el centro de la nanotecnología se encuentran las nanopartículas, partículas extremadamente pequeñas con al menos una dimensión en el rango de los nanómetros (Bhushan, 2017). Estas pueden estar compuestas por diversos materiales, como metales, óxidos, polímeros y compuestos híbridos. Presentan propiedades físicas, químicas y biológicas que difieren significativamente de las de sus contrapartes a mayor escala. Esta diferenciación se debe a fenómenos cuánticos y a una mayor relación superficie-volumen, lo cual amplifica sus características y reactividad (Roco, 2003; Whitesides, 2003). La capacidad de la nanotecnología para manipular nanopartículas con precisión ha llevado al desarrollo de innovaciones en diferentes áreas con una gran importancia en los avances tecnológicos (Rai et al., 2009).
Entre las clasificaciones de nanopartículas que actualmente se conocen se encuentra la clasificación por composición, en la Tabla 1, se muestran algunos tipos de nanopartículas (Bhattacharyya et al., 2019).
Tabla 1
Clasificación y tipos de nanopartículas.
[i] Fuente: Adaptada de Bawendi et al. (1990) y Laurent et al. (2008).
Algunas nanopartículas representan una frontera prometedora en el área de salud, especialmente en el tratamiento de la enfermedad renal crónica, específicamente en la remoción de toxinas urémicas, debido a su capacidad para ser diseñadas a nivel molecular e interactuar de manera específica con diferentes toxinas (Yantasee et al., 2019). Su alta área superficial, las convierte en una herramienta valiosa para mejorar las técnicas de hemodiálisis y otros tratamientos de purificación de sangre (Ye et al., 2007).
Modificación superficial y funcionalización de nanopartículas para adsorción de toxinas urémicas
Las nanopartículas, como se mencionó con anterioridad, son de gran interés en una variedad de campos, sin embargo, para maximizar sus propiedades y estabilidad en diferentes entornos, a menudo es necesario modificar su superficie (Sperling et al., 2008; Dykman et al., 2012). La modificación superficial de nanopartículas es una técnica clave en la nanotecnología, consistente en cualquier alteración de la superficie de un material para cambiar sus propiedades (Gupta et al., 2005). Esta técnica se aplica a una variedad de nanopartículas, incluyendo metales, óxidos metálicos y materiales semiconductores, y es utilizada en campos como la biomedicina, la catálisis y los dispositivos electrónicos (Huber, 2005; Hu et al., 1999).
Dentro de los métodos más comunes de modificación superficial se encuentran los recubrimientos, tratamientos físicos y los tratamientos químicos (Dresselhaus et al., 1996). Particularmente, uno de los métodos de mayor auge en la actualidad es la funcionalización, este proceso consiste en adicionar grupos funcionales específicos en la superficie de la molécula o material con el fin de conferirle o aumentar características y propiedades importantes para su uso. Esta técnica presenta mejores resultados en las aplicaciones de los materiales (Lijima, 1991).
La funcionalización de nanopartículas para la adsorción de toxinas urémicas es un área de investigación activa donde se busca mejorar la eficiencia de los materiales adsorbentes para el tratamiento de la ERC como se ha visto en algunas referencias de trabajos de investigación (Cheah et al., 2016; Ooi et al., 2019). La funcionalización en nanopartículas para aplicación en membranas de hemodiálisis implica la adición de grupos funcionales en la superficie de las nanopartículas con el fin de aumentar su propiedad de adsorción y selectividad de toxinas urémicas como la urea y la creatinina (Nguyen et al., 2021; Mosavi et al., 2023; Miardan et al., 2023).
Uno de los enfoques más comunes hoy en día es la introducción de grupos químicos específicos en la superficie de las nanopartículas, como grupos carboxilo (-COOH) o grupos amino (-NH2), los cuales pueden interactuar con las toxinas urémicas a través de enlaces químicos (Lin et al., 2012). Esto mejora la afinidad de las nanopartículas por las toxinas urémicas y permite una adsorción más eficiente y selectiva. Además, la funcionalización puede mejorar la estabilidad y la biocompatibilidad de las nanopartículas, siendo esto crucial para su aplicación en sistemas biológicos (Kim et al., 2014; Lu et al., 2007). Se han reportado diferentes métodos de funcionalización, como la síntesis in situ de grupos funcionales durante la preparación de las nanopartículas, la modificación post-síntesis mediante reacciones químicas específicas o la modificación superficial mecánica por ultrasonido, siendo esta ultima la de mayor utilización por sus mejores resultados de modificación sin daños en la estructura y subproductos (Wang et al., 2015).
Nanomateriales a base de carbón para remoción de toxinas urémicas
Los nanomateriales a base de carbón o materiales carbonosos, los cuales incluyen los nanotubos de carbono, el grafeno y los puntos cuánticos de carbono, han demostrado ser altamente efectivos en la remoción de toxinas urémicas debido a su gran área superficial y capacidad de adsorción selectiva. Estos materiales pueden adsorber selectivamente toxinas de bajo peso molecular mientras minimizan la pérdida de proteínas y otros componentes importantes en la sangre. Varios estudios han demostrado la eficacia de los nanomateriales carbonosos en la eliminación de urea y creatinina en modelos animales y sistemas de diálisis in vitro (Zhang et al., 2021; Lin et al., 2016). Además de su elevada eficacia de remoción, los nanomateriales a base de carbón también ofrecen otras ventajas, como su biocompatibilidad y estabilidad química (Zheng et al., 2016, Yu et al., 2017). Estas propiedades los hacen prometedores para su uso en aplicaciones clínicas para el tratamiento de la enfermedad renal crónica. Sin embargo, se requiere más investigación para optimizar su eficacia, evaluar su seguridad a largo plazo y desarrollar sistemas de administración clínica efectivos (Jiang et al., 2020; Wang et al., 2021).
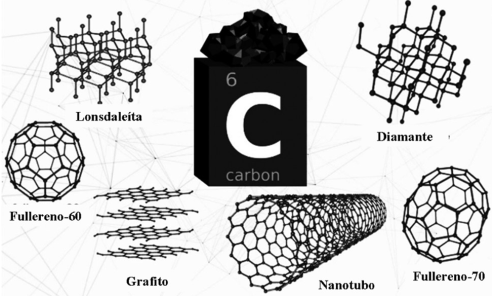
Algunos materiales carbonosos de gran importancia en la actualidad son el carbón black, nanotubos de carbono, grafeno, grafito, entre otros (Donaldson et al., 2003). Particularmente, el carbón black es un material producido por la combustión incompleta de hidrocarburos, como el gas natural o el petróleo. Consiste principalmente en partículas de carbono en forma de esferas o cadenas ramificadas, con tamaños de partícula yendo desde unos pocos nanómetros hasta varios cientos de ellos (Sanders et al., 2011). Este material desempeña un papel crucial en diversas industrias debido a sus propiedades únicas y beneficiosas. Además, su capacidad para mejorar las propiedades mecánicas y eléctricas de los materiales, lo hace un aditivo importante en la actualidad (Sharif et al., 2009).
Por su parte, los nanotubos de carbono son estructuras cilíndricas de carbono con propiedades únicas y extraordinarias. Estos nanomateriales han revolucionado diversos campos debido a su resistencia, conductividad eléctrica y térmica excepcionales, así como su relación resistencia-peso sobresaliente (Lijima, 1991). Este nanomaterial tiene un impacto significativo en diversas áreas, incluyendo la electrónica, la energía, la medicina y los materiales compuestos. Siendo esta última área la de mayor impacto en las propiedades de estos materiales (Dresselhaus et al., 1996; Li et al., 2003).
Otro material de carbón importante es el grafeno, este es un material bidimensional compuesto por una única capa de átomos de carbono dispuestos en una estructura hexagonal (Novoselov et al., 2004). Este material ha generado un gran interés debido a sus propiedades únicas y extraordinarias como su conductividad, resistencia, ligereza, biocompatibilidad y capacidad para interactuar con biomoléculas, convirtiéndolo en uno de los materiales más prometedores en diversas aplicaciones tecnológicas y científicas (Geim et al., 2007; Schwierz, 2010).
Por último, las nanofibras de carbono son un nanomaterial importante dentro de la gama de materiales carbonos en la tecnología, estas son estructuras cilíndricas compuestas por múltiples capas de grafeno enrolladas en forma de tubo (Baughman et al., 2002). Estos nanomateriales tienen propiedades mecánicas y eléctricas excepcionales, haciéndolos ideales para una amplia gama de aplicaciones en áreas como la electrónica, la energía y los materiales compuestos. Las nanofibras de carbono son un material fascinante con propiedades únicas haciéndolas valiosas en numerosas aplicaciones (Andrews et al., 2002). Su capacidad para mejorar la conductividad, resistencia y otras propiedades mecánicas y eléctricas las convierte en una herramienta invaluable para la innovación en la ciencia y la tecnología modernas (Zhang et al., 2004). Todos estos materiales nanoestructurados presentan diferente estructura (Figura 3).
La adsorción de toxinas urémicas en diferentes medios conlleva a la utilización de modelos de adsorción como el de Langmuir, el de Freundlich y el de Halsey. Este último modelo fue desarrollado en 1948 y presenta una ecuación empleada para describir la condensación de las multicapas, es decir, la adsorción en superficies heterogéneas, asumiendo que el potencial energético de una molécula varía de manera inversamente proporcional a su distancia respecto a la superficie (Chu et al., 2023). Esta ecuación se ocupa principalmente en estudios de adsorción física debido a que describe la isoterma de adsorción, la cual ilustra cómo las moléculas de un adsorbato se reparten entre la fase sólida (adsorbente) y la fase líquida o gaseosa en equilibrio a una temperatura constante:
Donde θ es la cobertura de la superficie a la presión relativa p/p 0 (p y p 0 son las presiones de equilibrio y de saturación), y k y n son constantes características para el sistema de adsorción y la temperatura dados. En la práctica, esta ecuación se puede adaptar y combinar con otros modelos de adsorción, como los de Langmuir o Freundlich, dependiendo de cómo interactúan las toxinas con la superficie del nanomaterial de carbón (Martín et al., 1990).
Entre las investigaciones del uso de estos nanomateriales a base de carbón con aplicación en la enfermedad renal crónica se han reportado las siguientes:
Malik et al. (2005) reportaron carbones activados mesoporosos derivados de polímero para la adsorción de toxinas urémicas, donde sus resultados confirman la adsorción de toxinas por medio de poros de los carbones. Esta investigación fue la pauta de otras investigaciones con base en materiales carbonos para la remoción de toxinas urémicas. Por su parte, Ye et al. (2007) dieron a conocer la utilización de nanotubos de carbono (NTC) para la adsorción de urea y vitamina B12 en comparación con carbón activado y resina mesoporosa, obteniendo como resultados una adsorción 10 veces mejor en los NTC respecto a los otros dos materiales evaluados. Aunque los resultados de estas investigaciones fueron prometedoras, los siguientes años no hubo reportes de avances de investigaciones con base en el carbón con esta aplicación, las investigaciones se desviaron a mejores usos de los materiales carbonoso como aislantes y otras aplicaciones. Años después, Pavlenko et al. (2017) reportaron la fabricación de adsorbentes de carbono con porosidad dual para la eliminación eficiente de toxinas urémicas y citocinas del plasma humano, obteniendo como resultado una alta capacidad de adsorción hacia pequeñas toxinas solubles en agua (creatinina), moléculas unidas a proteína y citocinas. Por otro lado, Alvarado et al. (2019) investigaron sobre la obtención de nanoplaquetas de grafeno modificadas con diaminas mediante el método de ultrasonido de frecuencia variable, los resultados publicados fueron prometedores debido a que presentaron una adsorción de toxinas urémicas del 97%, además, sus resultados mostraron actividad no citotóxica y un bajo grado de hemólisis. Un año después, el mismo grupo de trabajo reportó una nueva investigación donde Andrade-Guel et al. (2019) dieron a conocer la modificación de nanoplaquetas de grafeno con ácidos mediante radiación ultrasónica de 350 W para su aplicación en adsorción de toxinas urémicas presentando una adsorción monocapa de 75%, resultados prometedores para su aplicación. Estos resultados dieron pie a diversas investigaciones en cuanto a la adsorción de toxinas urémicas a base de carbón.
Dentro de la literatura comprendida en los siguientes años, Kameda et al. (2020) escribieron sobre carbón activado para la adsorción de toxinas urémicas, donde en los resultados demostraron que la adsorción de urea y creatina sobre carbón activado esférico progresa con una velocidad de pseudosegundo orden y de acuerdo con la fórmula de Halsey, con una adsorción de urea del 65%. Por su parte Liu et al. (2021) propusieron un método sencillo para fabricar adsorbentes de carbono porosos conteniendo nitrógeno para eliminar las toxinas urémicas unidas a proteínas, mostrando con esta investigación resultados favorables de adsorción en materiales con grupos nitrógeno en su superficie, estos resultados mostraron la adsorción de urea y hemocompatibilidad. Un año después, los avances siguieron reportándose, por su lado, Alvarado et al. (2022) dieron a conocer la obtención de nanocompuesto de nylon 6 con carbón black modificadas con grupos amino, donde se presentó un aumento de adsorción de toxinas urémicas entre 80 a 90% respecto a un dispositivo comercial y una pérdida de albúmina del 6%, parámetro importante de selectividad. Los últimos avances reportados en la literatura hasta el momento fueron por Yang et al. (2023) quienes presentaron nanofibras de carbono porosas nanoestructuradas con zeolitas dopadas con nitrógeno para la adsorción de toxinas urémicas con un diámetro uniforme de 25 nm, estas fueron comparadas con nanofibras de carbono porosas no dopadas mostrando resultados de adsorción de creatinina 1.8 veces mayor en las nanofibras dopadas con zeolita. En el mismo año, Shoueir et al. (2023) reportaron la fabricación de perlas nanocompuestas de alginato de bario y grafeno de pocas capas para la adsorción de la toxina creatinina, donde sus resultados mostraron la eliminación de creatinina en un 82%, resultados prometedores en la remoción de toxinas urémicas.
Como se puede apreciar hasta el momento, los nanomateriales a base de carbón son un tema de estudio para la remoción y adsorción de toxinas urémicas en pacientes con ERC, siendo este uno de los materiales con mejores resultados hasta el momento. Las investigaciones reportan que la funcionalización de las nanopartículas con grupos nitrogenados aumentan las propiedades de adsorción y selectividad de los materiales en esta aplicación. Por lo anterior, estas investigaciones respaldan la importancia de los materiales carbonosos para el desarrollo de nuevas tecnologías debido a sus propiedades únicas (Coleman et al., 2006; Raccichini et al., 2015).
Nanomateriales de óxido de silicio para remoción de toxinas urémicas
Los nanomateriales de óxido de silicio han emergido como una opción prometedora para la remoción de toxinas urémicas debido a sus ventajas entre las cuales destacan su alta área superficial, distribución uniforme de poros y su porosidad, permitiéndoles adsorber eficientemente toxinas urémicas de la sangre (Li et al., 2017). Además, pueden ser funcionalizados con grupos químicos específicos para mejorar su capacidad de adsorción y selectividad hacia ciertas toxinas (Feng et al., 2018). Estos nanomateriales también son biocompatibles y estables, haciéndolos adecuados para aplicaciones biomédicas (Zhang et al., 2016; Cai et al., 2006). Estudios recientes han demostrado que los nanomateriales de óxido de silicio pueden ser tan efectivos como los nanomateriales carbonosos en la eliminación de urea y creatinina, y pueden ofrecer ventajas adicionales en términos de estabilidad y biocompatibilidad.
Entre las investigaciones del uso de estos nanomateriales de óxido de silicio con aplicación en remoción de toxinas urémicas hasta el momento se han reportado los siguientes:
La primera investigación con base en óxido de silicio conocida fue la de Cheah et al. (2016) donde reportaron sílice mesoporosa funcionalizada con amina para la adsorción de urea respecto a una comparación con carbón activado, los resultados analizados fueron favorables debido a la funcionalización de la sílice, la cual aumentó su capacidad de adsorción de urea, obteniendo datos prometedores al ser la sílice mesoporosa un material que podría potencialmente remplazar al carbón activado. Tres años después, el mismo grupo de trabajo estudió la adsorción de toxinas urémicas en diferentes materiales nanoporosos, específicamente el carbón activado derivado y sílice funcionalizada con amina, los resultados mostraron una alta capacidad de adsorción de urea debido a la presencia de grupos funcionales en la superficie de los nanomateriales. Aunque los resultados reportados con estas investigaciones fueron favorables, un año después Nguyen et al. (2021) dieron a conocer otra investigación donde se mostró la adsorción mejorada y selectiva de urea y creatinina en sílice mesoporosa funcionalizada con amina mediante enlaces de hidrógeno, aumentando la remocion de urea y obteniendo una absorción selectiva causada por su enlace de hidrógeno de los grupos amino en la superficie de la silice. Por su parte, Mosavi et al. (2023) escribieron sobre la síntesis de un núcleo-cubierta IRMOF-1-SiO2 y amino funcionalización con 3-aminopropyltriethoxysilane, mostrando en sus resultados la eliminación con éxito del 92.57% de la urea y el 80.47% de la creatinina. En el mismo año Miardan et al. (2023) reportaron la síntesis de nanopartículas de sílice mesoporosas funcionalizada con amina unidas por polímeros, mostrando una capacidad favorable para eliminar toxinas urémicas debido a la unión de dos materiales porosos lo cual dio lugar a un aumento de la superficie porosa. Los resultados de las nanopartículas de la sílice mesoporosas funcionalizadas con amina presentaron la eliminación de cantidades significativas de creatinina y ácido úrico. Siendo esta la última investigación reportada hasta el momento con base en materiales de óxido de silicio para remoción de toxinas urémicas en hemodiálisis.
Como se puede observar hasta el momento, los nanomateriales de óxido de silicio son un tema de estudio con poco auge para la remoción y adsorción de toxinas urémicas en pacientes con enfermedad renal crónica; sin embargo, los artículos antes presentados muestran resultados prometedores y avalan la implementación de este material como sustituto de los nanomateriales carbonosos, debido a sus mejores resultados de adsorción o remoción de toxinas urémicas y la mayor facilidad para modificación de la superficie con grupos nitrogenados, además de ser un material biocompatible.
Dentro de la clasificación de las nanopartículas también se encuentran los óxidos metálicos; no obstante, entre los artículos reportados hasta el día de hoy en el área de salud y adsorción de toxinas urémicas, solo se encontró que el investigador Ding et al. (2022) usó nanopartículas de óxidos MgAl de dobles en capas jerárquicamente estructurales, para la eliminación de toxinas urémicas ligadas a proteínas, esta investigación dio como resultado la adsorción por interacción electrostática de toxinas HA e IS de 129.8 mg/g y 63.1 mg/g, respectivamente. Este estudio dio la pauta para dar a conocer que los óxidos metálicos no presentan buenos resultados en esta área por lo cual ya no se reportaron nuevos avances en el uso de estos materiales.
Nanocompuestos poliméricos adsorbentes de toxinas urémicas
Los nanocompuestos poliméricos adsorbentes combinan las propiedades únicas de los polímeros con las ventajas de las nanopartículas para crear materiales con alta capacidad de adsorción. Estos nanocompuestos se utilizan en una amplia gama de aplicaciones, desde la remoción de contaminantes en el agua hasta la captura de gases industriales y la purificación de productos químicos (Waring et al., 2015; Chen et al., 2012) Estos materiales están formados por una matriz polimérica en la cual se dispersan uniformemente nanopartículas. Las nanopartículas comunes utilizadas incluyen óxidos metálicos (como TiO2, ZnO), nanotubos de carbono, grafeno y nanopartículas de sílice. La combinación de estas nanopartículas con polímeros mejora las propiedades mecánicas, térmicas y adsorbentes del material resultante (Kausar et al., 2018). Los nanocompuestos poliméricos adsorbentes han emergido como una solución innovadora y eficaz para la adsorción y eliminación de toxinas urémicas. Estos materiales ofrecen una alta capacidad de adsorción y selectividad, mejorando significativamente la calidad de vida de estos pacientes. Estos son compuestos por una matriz polimérica, la cual incorpora nanopartículas funcionalizadas para mejorar la capacidad de adsorción (Gao et al., 2022).
Las investigaciones abordadas con anterioridad de materiales carbonosos y óxido de silicio, presentan la utilización de nanocompuestos poliméricos para la fabricación de membranas para hemodiálisis presentando una mejor adsorción de toxinas urémicas; asimismo, analizan el comportamiento de estos nanocompuestos ante toxinas urémicas en pruebas in vitro. Como se puede ver hasta el momento en el área de la salud, específicamente en hemodiálisis, las investigaciones y aportes científicos de los investigadores han sido importantes debido a los resultados de remoción de toxinas urémicas y el aumento de eficiencia en el tratamiento.
Los nanocompuestos poliméricos adsorbentes representan un avance significativo en el tratamiento de la insuficiencia renal crónica, ofreciendo mejoras críticas en la capacidad de adsorción, selectividad y biocompatibilidad (Kausar et al., 2018). Estos materiales tienen el potencial de transformar la práctica de la hemodiálisis, proporcionando mejores resultados clínicos y una mayor calidad de vida para los pacientes. La investigación y desarrollo continuo en este campo es esencial para explorar nuevas aplicaciones y mejorar aún más la eficacia de estos materiales adsorbentes innovadores (Cai et al., 2006; Nguyen et al., 2021).
La Tabla 2 muestra un resumen de los tipos de compuestos y su capacidad de remoción, con el fin de presentar una comparación en los avances científicos de los materiales adsorbentes de toxinas urémicas.
Tabla 2
Tipos de compuestos.
| Compuestos | Material | Capacidad de remoción | Referencia bibliográfica |
|---|---|---|---|
| Nanomateriales carbonosos | Carbón activado mesoporoso. | 75% | Malik et al. (2005) |
| Nanotubos de carbono vs carbón activado. | 10 veces más adsorción en nanotubos de carbono. | Ye et al. (2007) | |
| Adsorbentes de carbono con porosidad dual | Alta capacidad de adsorción en toxinas de bajo peso molecular. | Palenko et al. (2017) | |
| Nanoplaquetas de grafeno modificadas con diaminas. | 97% de adsorción de toxinas urémicas. | Alvarado et al. (2019) | |
| Nanoplaquetas de grafeno modificadas con ácidos. | 75% de adsorción de toxinas de tipo monocapa. | Guel et al. (2019) | |
| Carbón activado esférico. | 65% de adsorción de urea. | Kameda et al. (2020) | |
| Adsorbentes de carbono con nitrógeno. | Adsorción mayor de toxinas ligadas a proteínas. | Liu et al. (2021) | |
| Nanofibras de carbono porosas nanoestructuradas con zeolitas y dopadas con nitrógeno | 1.8 veces mayor adsorción de creatinina que en nanofibras sin dopar. | Yang et al. (2023) | |
| Perlas nanocompuestas de alginato de bario y grafeno. | 82% de adsorción de creatinina. | Shoueir et al. (2023) | |
| Nanomateriales de óxido de silicio | Sílice meosoporosa funcionalizada con amina vs carbón activado. | Mayor adsorción en sílice, respecto al carbón activado. | Cheah et al. (2016) |
| Sílice meosoporosa funcionalizada con amina mediante enlaces de hidrógeno. | Adsorción selectiva de urea y creatinina mayor al 80%. | Nguyen et al. (2021) | |
| Núcleo-cubierta IRMOF-1-SiO2 y amino funcionalizada con aminas. | Eliminación del 92.57% de urea y 80.47% de creatinina. | Mosavi et al. (2023) | |
| Nanopartículas de sílice mesoporosas funcionalizadas con minas unidas por polímeros. | Eliminación de creatinina y ácido úrico mayor al 80%. | Miardan et al. (2023) | |
| Nanocompuestos poliméricos | Nanocompuestos de nylon 6 con carbón black modificado con grupos amino. | 80-90% de adsorción de toxinas urémicas. | Alvarado et al. (2022) |
Resultados prometedores en la actualidad
Las investigaciones de materiales adsorbentes de toxinas urémicas más recientes hasta la actualidad fueron descritas en este artículo de revisión. Estos resultados han demostrado avances significativos destacando algunos nanomateriales con mayor eficacia que otros. Entre los resultados más importantes se encuentran los materiales nanocompuestos donde Alvarado et al. (2019) presentaron una adsorción del 97% de toxinas urémicas en nanoplaquetas de grafeno modificadas. Por su parte Mosavi et al. (2023) dieron a conocer nanopartículas de SiO2 modificadas con aminas, con una adsorción del 93% de urea. Estos materiales presentan mayor porcentaje de adsorción de toxinas urémicas según los resultados citados debido a la mejora en su compatibilidad con las toxinas urémicas, además de tener una buena biocompatibilidad y una mayor selección de toxinas urémicas dañinas para el organismo. Estas ventajas son imprescindibles para aumentar el rendimiento en los filtros para hemodiálisis y a su vez elevar la calidad de vida en los pacientes.
Por otra parte, dentro de los materiales antes mencionados, los mejores resultados sin modificación de nanopartículas fueron reportados en los materiales carbonosos por Ye et al. (2007), investigación en donde se presentó una adsorción 10 veces más alta en nanotubos de carbono vs carbón activado, debido a sus propiedades adsorbentes y a su hemocompatibilidad reportada. Sin embargo, aún faltan muchos más avances y estudios profundos para develar cuáles son los materiales óptimos para la adsorción de toxinas urémicas en pacientes con ERC.
Conclusión
En conclusión, los nanomateriales a base de carbón y óxido de silicio representan una nueva y prometedora clase de adsorbentes para la remoción de toxinas urémicas en pacientes con enfermedad renal crónica. Estos materiales ofrecen una alta capacidad de adsorción y selectividad para toxinas de bajo peso molecular, como la urea y la creatinina, las cuales son difíciles de eliminar con técnicas convencionales de diálisis. Además, los nanomateriales presentan propiedades como su biocompatibilidad y estabilidad, haciéndolos muy adecuados para aplicaciones clínicas.
No obstante, a pesar de los avances en este campo, aún existen desafíos que deben abordarse. Estos incluyen la optimización de la eficacia de remoción, la evaluación de la seguridad a largo plazo y la implementación efectiva en sistemas de diálisis clínica. Se necesita más investigación para abordar estos desafíos y llevar los nanomateriales a base de carbono y óxido de silicio desde el laboratorio hasta la práctica clínica, con el objetivo de mejorar el tratamiento y la calidad de vida de los pacientes.
Perspectivas a futuro
Las perspectivas futuras de los nanomateriales carbonosos y de óxido de silicio para la remoción de toxinas urémicas en la ERC son prometedoras y sugieren varias áreas de desarrollo y aplicación, como la mejora de la eficacia y selectividad, esperando avances en la síntesis y el diseño de nanomateriales permitiendo así mejorar aún más su capacidad de adsorción y selectividad para toxinas urémicas. Otra área futura por atender es la seguridad y biocompatibilidad de los nanomateriales hacia la aplicación clínica, a través de una investigación exhaustiva sobre su seguridad a largo plazo y su biocompatibilidad en entornos clínicos relevantes. Se espera que los avances en la investigación y la tecnología permitan su aplicación clínica efectiva, mejorando así el tratamiento y la calidad de vida de los pacientes.
Agradecimientos
los autores agradecen el financiamiento del Proyecto Conahcyt 320802: “Desarrollo de filtros selectivos nacionales a base de polímeros y nanopartículas modificadas”, para mejorar el tratamiento de hemodiálisis y sustituir el acaparamiento del mercado de empresas extranjeras. Fondo F003 Convocatoria de Ciencia Básica y/o Ciencia de Frontera. Modalidad: Paradigmas y Controversias de la Ciencia. Así como también agradecen a Conahcyt por la beca 001776 de doctorado en la convocatoria Becas Nacional (Tradicional) 2023-1.
Referencias
Akchurin, O. M. (2019). Chronic kidney disease and dietary measures to improve outcomes. Pediatric Clinics of North America, 66(1): 247-267. https://doi.org/10.1016/j.pcl.2018.09.007.
O. M. Akchurin 2019Chronic kidney disease and dietary measures to improve outcomesPediatric Clinics of North America66124726710.1016/j.pcl.2018.09.007
Alvarado, C. et al. (2019). Graphene nanoplatelets modified with amino-groups by ultrasonic radiation of variable frequency for potential adsorption of uremic toxins. Nanomaterials, 9(9): 1261. https://doi.org/10.3390/nano9091261.
C. Alvarado 2019Graphene nanoplatelets modified with amino-groups by ultrasonic radiation of variable frequency for potential adsorption of uremic toxinsNanomaterials99126110.3390/nano9091261
Alvarado, C. et al. (2022). Non-woven fabrics based on nylon 6/carbon black-graphene nanoplatelets obtained by melt-blowing for adsorption of urea, uric acid and creatinine. Material Letters, 320: 132382. Elservier. https://doi.org/10.1016/j.matlet.2022.132382.
C. Alvarado 2022Non-woven fabrics based on nylon 6/carbon black-graphene nanoplatelets obtained by melt-blowing for adsorption of urea, uric acid and creatinineMaterial Letters320132382Elservier10.1016/j.matlet.2022.132382
Andrade-Guel, M. L., Cabello-Alvarado, Ch., Cruz-Delgado, V. J., Bartolo-Pérez, P., De León-Martínez, P. A., Sáenz-Galindo, A., Cadenas-Pliego, G., Ávila-Orta, C. A. (2019). Surface modification of graphene nanoplatelets by organic acids and ultrasonic radiation for enhance uremic toxins adsorption. México. https://doi.org/10.3390/ma12050715.
M. L. Andrade-Guel Ch. Cabello-Alvarado V. J. Cruz-Delgado P. Bartolo-Pérez P. A. De León-Martínez A. Sáenz-Galindo G. Cadenas-Pliego C. A. Ávila-Orta 2019Surface modification of graphene nanoplatelets by organic acids and ultrasonic radiation for enhance uremic toxins adsorptionMéxico10.3390/ma12050715
Andreoli, M. C. C. y Totoli, C. (2020). Peritoneal dialysis. Revista Da Associacao Medica Brasileira (1992): 66(Suppl 1): s37-s44. https://doi.org/10.1590/1806-9282.66.S1.37.
M. C. C. Andreoli C. Totoli 2020Peritoneal dialysisRevista Da Associacao Medica Brasileira1992661s37s4410.1590/1806-9282.66.S1.37
Andrews, R., Jacques, D., Minot, M., Rantell, T., Saini, R. K. y Loadmann, M. (2002). Fabrication of carbon multiwall nanotube/polymer composites by shear mixing. Macromolecular Materials and Engineering, 287(6): 395-403. https://doi.org/10.1002/1439-2054(20020601)287:6<395::AID-MAME395>3.0.CO;2-S.
R. Andrews D. Jacques M. Minot T. Rantell R. K. Saini M. Loadmann 2002Fabrication of carbon multiwall nanotube/polymer composites by shear mixingMacromolecular Materials and Engineering287639540310.1002/1439-2054(20020601)287:6<395::AID-MAME395>3.0.CO;2-S
Argaiz, E. R., Morales-Juárez, L., Razo, C., Ong, L., Rafferty, Q., Rincón-Pedrero, R. y Gamba, G. (2023). La carga de enfermedad renal crónica en México. Análisis de datos basado en el estudio. Global burden of disease. Gaceta Médica de México, 159(6). https://doi.org/10.24875/GMM.23000393.
E. R. Argaiz L. Morales-Juárez C. Razo L. Ong Q. Rafferty R. Rincón-Pedrero G. Gamba 2023La carga de enfermedad renal crónica en México. Análisis de datos basado en el estudio. Global burden of diseaseGaceta Médica de México159610.24875/GMM.23000393
Ávila-Saldívar, M. N., Conchillos-Olivares, G., Rojas-Báez, I. C., Elizabeth, A. (2013) Enfermedad renal crónica: causa y prevalencia en la población del Hospital General La Perla. Med. Interna Mex. 29 (5): 473-478.
M. N. Ávila-Saldívar G. Conchillos-Olivares I. C. Rojas-Báez A. Elizabeth 2013Enfermedad renal crónica: causa y prevalencia en la población del Hospital General La PerlaMed. Interna Mex295473478
Baughman, R. H., Zakhidov, A. A. y de Heer, W. A. (2002). Carbon nanotubes - The route toward applications. Science, 297(5582): 787-792. https://doi.org/10.1126/science.1060928.
R. H. Baughman A. A. Zakhidov W. A. de Heer 2002Carbon nanotubes - The route toward applicationsScience297558278779210.1126/science.1060928
Bawendi, M. G., Steigerwald, M. L. y Brus, L. E. (1990). The quantum mechanics of larger semiconductor clusters (“quantum dots”). Annual Review of Physical Chemistry, 41(1): 477-496. https://doi.org/10.1146/annurev.pc.41.100190.002401.
M. G. Bawendi M. L. Steigerwald L. E. Brus 1990The quantum mechanics of larger semiconductor clusters (“quantum dots”)Annual Review of Physical Chemistry41147749610.1146/annurev.pc.41.100190.002401
Cai Q., Luo Z. S., Pang, W. Q., Fan, Y. W., Chen, X. H., Cui, F. Z. (2006). Biocompatibility of a mesoporous silica nanoparticle (MSN)-carbon nanotube (CNT) composite with endothelial cells. J Nanosci Nanotechnol, 6(3): 785-91. https://doi.org/10.1166/jnn.2006.163.
Luo Z. S. Cai Q. W. Q. Pang Y. W. Fan X. H. Chen F. Z. Cui 2006Biocompatibility of a mesoporous silica nanoparticle (MSN)-carbon nanotube (CNT) composite with endothelial cellsJ Nanosci Nanotechnol6378579110.1166/jnn.2006.163
Cheah, W.-K., Sim, Y.-L. y Yeoh, F.-Y. (2016). Amine-functionalized mesoporous silica for urea adsorption. Materials Chemistry and Physics, 175: 151-157. https://doi.org/10.1016/j.matchemphys.2016.03.007.
W.-K. Cheah Y.-L. Sim F.-Y. Yeoh 2016Amine-functionalized mesoporous silica for urea adsorptionMaterials Chemistry and Physics17515115710.1016/j.matchemphys.2016.03.007
Chen, H., Li, J., Shao, D., Ren, X. y Wang, X. (2012). Poly (acrylic acid) grafted multiwall carbon nanotubes by plasma techniques for Co(II) removal from aqueous solution. Chemical Engineering Journal, 210: 475-481. https://doi.org/10.1016/j.cej.2012.08.082.
H. Chen J. Li D. Shao X. Ren X. Wang 2012Poly (acrylic acid) grafted multiwall carbon nanotubes by plasma techniques for Co(II) removal from aqueous solutionChemical Engineering Journal21047548110.1016/j.cej.2012.08.082
Chu, K. H., Bashiri, H., Hashim, M. A., Abd Shukor, M. Y. y Bollinger, J.-C. (2023). The Halsey isotherm for water contaminant adsorption is fake. Separation and Purification Technology, 313: 123500. https://doi.org/10.1016/j.seppur.2023.123500.
K. H. Chu H. Bashiri M. A. Hashim M. Y. Abd Shukor J.-C. Bollinger 2023The Halsey isotherm for water contaminant adsorption is fakeSeparation and Purification Technology31312350010.1016/j.seppur.2023.123500
Coleman, J. N., Khan, U., Blau, W. J. y Gun’ko, Y. K. (2006). Small but strong: a review of the mechanical properties of carbon nanotube-polymer composites. Carbon, 44(9): 1624-1652. https://doi.org/10.1016/j.carbon.2006.02.038.
J. N. Coleman U. Khan W. J. Blau Y. K. Gun’ko 2006Small but strong: a review of the mechanical properties of carbon nanotube-polymer compositesCarbon4491624165210.1016/j.carbon.2006.02.038
Ding, S., Wang, D. y Wang, X. (2022). Hierarchically structural layered double oxides with stretchable nanopores for highly effective removal of protein-bound uremic toxins. Separation and Purification Technology, 301: 122033. https://doi.org/10.1016/j.seppur.2022.122033.
S. Ding D. Wang X. Wang 2022Hierarchically structural layered double oxides with stretchable nanopores for highly effective removal of protein-bound uremic toxinsSeparation and Purification Technology30112203310.1016/j.seppur.2022.122033
DOF. (2022). Acuerdo Número ACDO.AS3.HCT.251121/301.P.DF. Aprobación de los costos unitarios por nivel de atención medica actualizada al 2022. Diario Oficial de la Federación (DOF). México. https://www.dof.gob.mx/nota_detalle.php?codigo=5672661&fecha=29/11/2022.
DOF 2022Acuerdo Número ACDO.AS3.HCT.251121/301.P.DF. Aprobación de los costos unitarios por nivel de atención medica actualizada al 2022Diario Oficial de la FederaciónDOFMéxicohttps://www.dof.gob.mx/nota_detalle.php?codigo=5672661&fecha=29/11/2022
Donaldson, K. y Stone, V. (2003). Current hypotheses on the mechanisms of toxicity of ultrafine particles. Annali Dell’Istituto Superiore Di Sanita, 39(3): 405-410.
K. Donaldson V. Stone 2003Current hypotheses on the mechanisms of toxicity of ultrafine particlesAnnali Dell’Istituto Superiore Di Sanita393405410
Dresselhaus, M. S., Dresselhaus, G. y Eklund, P. C. (1996). Science of fullerenes and carbon nanotubes: their properties and applications. Academic Press. https://doi.org/10.1021/ja965593l.
M. S. Dresselhaus G. Dresselhaus P. C. Eklund 1996Science of fullerenes and carbon nanotubes: their properties and applicationsAcademic Press10.1021/ja965593l
Duranton, F., Cohen, G., De Smet, R., Rodríguez, M., Jankowski, J., Vanholder, R. et al. (2012). Normal and pathologic concentrations of uremic toxins. J Am Soc Nephrol., 23(7): 1258-1270. https://doi.org/10.1681/ASN.2011121175.
F. Duranton G. Cohen R. De Smet M. Rodríguez J. Jankowski R. Vanholder 2012Normal and pathologic concentrations of uremic toxinsJ Am Soc Nephrol.2371258127010.1681/ASN.2011121175
Dykman, L. A. y Khlebtsov, N. G. (2012). Gold nanoparticles in biomedical applications: recent advances and perspectives. Chemical Society Reviews, 41(6): 2256-2282. https://doi.org/10.1039/C1CS15166E.
L. A. Dykman N. G. Khlebtsov 2012Gold nanoparticles in biomedical applications: recent advances and perspectivesChemical Society Reviews4162256228210.1039/C1CS15166E
El-Khatib, E. M. (2012). Antimicrobial and self-cleaning textiles using nanotechnology. Research Journal of Textile and Apparel, 16(3): 156-174. https://doi.org/10.1108/RJTA-16-03-2012-B016.
E. M. El-Khatib 2012Antimicrobial and self-cleaning textiles using nanotechnologyResearch Journal of Textile and Apparel16315617410.1108/RJTA-16-03-2012-B016
Evans, M., Lewis, R. D., Morgan, A. R., Whyte, M. B., Hanif, W., Bain, S. C., Davies, S., Dashora, U., Yousef, Z., Patel, D. C. y Strain, W. D. (2022). A narrative review of chronic kidney disease in clinical practice: current challenges and future perspectives. Advances in Therapy, 39(1): 33-43. https://doi.org/10.1007/s12325-021-01927-z.
M. Evans R. D. Lewis A. R. Morgan M. B. Whyte W. Hanif S. C. Bain S. Davies U. Dashora Z. Yousef D. C. Patel W. D. Strain 2022A narrative review of chronic kidney disease in clinical practice: current challenges and future perspectivesAdvances in Therapy391334310.1007/s12325-021-01927-z
Evenepoel, P., Meijers, B. K. I., Bammens, B. R. M., Verbeke, K. (2009). Uremic toxins originating from colonic microbial metabolism. Kidney Int Suppl., 76 (Suppl 114): S12-S19. https://doi.org/10.1038/ki.2009.402.
P. Evenepoel B. K. I. Meijers B. R. M. Bammens K. Verbeke 2009Uremic toxins originating from colonic microbial metabolismKidney Int Suppl.76114S12S1910.1038/ki.2009.402
Feng, X., Chen, A., Zhang, Y., Wang, J., Shao, L. et al. (2018). Silica nanocapsules with ultralarge pores for the removal of low-molecular weight uremic toxins. ACS Applied Materials & Interfaces, 10(6): v5465-5472. https://doi.org/10.1021/acsami.7b17197.
X. Feng A. Chen Y. Zhang J. Wang L. Shao 2018Silica nanocapsules with ultralarge pores for the removal of low-molecular weight uremic toxinsACS Applied Materials & Interfaces106v5465v547210.1021/acsami.7b17197
Ficheux, A., Kerr, P. G., Brunet, P. y Argiles, A. (2011). The ultrafiltration coefficient of a dialyser (KUF) is not a fixed value, and it follows a parabolic function: the new concept of KUF max. Nephrology Dialysis Transplantation, 26(2): 636-640. https://doi.org/10.1093/ndt/gfq510.
A. Ficheux P. G. Kerr P. Brunet A. Argiles 2011The ultrafiltration coefficient of a dialyser (KUF) is not a fixed value, and it follows a parabolic function: the new concept of KUF maxNephrology Dialysis Transplantation26263664010.1093/ndt/gfq510
Gao, C., Zhang, Q., Yang, Y., Li, Y. y Lin, W. (2022). Recent trends in therapeutic application of engineered blood purification materials for kidney disease. Biomaterials Research, 26(1). https://doi.org/10.1186/s40824-022-00250-0.
C. Gao Q. Zhang Y. Yang Y. Li W. Lin 2022Recent trends in therapeutic application of engineered blood purification materials for kidney diseaseBiomaterials Research26110.1186/s40824-022-00250-0
Giraldo, Y. G., Fernández, E. M. B., Muñoz, R. G., López, C. M. D. y Bouarich, H. (2023). Chronic kidney disease (I). Aetiopathogenisis, clinical manifestations, diagnosis and prognosis. Medicine - Accredited Continuing Medical Training Program, 13(80): 4730-4737. https://doi.org/10.1016/j.med.2023.05.012.
Y. G. Giraldo E. M. B. Fernández R. G. Muñoz C. M. D. López H. Bouarich 2023Chronic kidney disease (I). Aetiopathogenisis, clinical manifestations, diagnosis and prognosisMedicine - Accredited Continuing Medical Training Program13804730473710.1016/j.med.2023.05.012
Goicoechea, M. (2021). Ácido úrico y enfermedad renal crónica: afectación renal en las enfermedades sistémicas. Servicio de Nefrología. Hospital General Universitario Gregorio Marañón. Madrid. https://www.nefrologiaaldia.org/es-articulo-acido-urico-enfermedad-renal-cronica-200.
M. Goicoechea 2021Ácido úrico y enfermedad renal crónica: afectación renal en las enfermedades sistémicasServicio de Nefrología. Hospital General Universitario Gregorio MarañónMadridhttps://www.nefrologiaaldia.org/es-articulo-acido-urico-enfermedad-renal-cronica-200
Guerreiro, J. F., Pereira da Silva, M., Bordonhos, M., Minhalma, M., Pinto, M. L. y De Pinho, M. N. (2023). Synthesis and characterization of MOF/silica cellulose acetate-based membranes: removal of uremic toxins in haemodialysis spent dialysate. Desalination, 565: 116860. https://doi.org/10.1016/j.desal.2023.116860.
J. F. Guerreiro M. Pereira da Silva M. Bordonhos M. Minhalma M. L. Pinto M. N. De Pinho 2023Synthesis and characterization of MOF/silica cellulose acetate-based membranes: removal of uremic toxins in haemodialysis spent dialysateDesalination56511686010.1016/j.desal.2023.116860
Gupta, A. K. y Gupta, M. (2005). Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications. Biomaterials, 26(18): 3995-4021. https://doi.org/10.1016/j.biomaterials.2004.10.012.
A. K. Gupta M. Gupta 2005Synthesis and surface engineering of iron oxide nanoparticles for biomedical applicationsBiomaterials26183995402110.1016/j.biomaterials.2004.10.012
Hernández, O. (2021). Alotropos. México. https://www.youtube.com/@prof.osvaldohernandez.
O. Hernández 2021AlotroposMéxicohttps://www.youtube.com/@prof.osvaldohernandez
Hill, N. R., Fatoba, S. T., Oke, J. L., Hirst, J. A., O’Callaghan, C. A., Lasserson, D. S. y Hobbs, F. D. R. (2016). Global prevalence of chronic kidney disease - a systematic review and meta-analysis. PLoS One, 11(7): e0158765. https://doi.org/10.1371/journal.pone.0158765.
N. R. Hill S. T. Fatoba J. L. Oke J. A. Hirst C. A. O’Callaghan D. S. Lasserson F. D. R. Hobbs 2016Global prevalence of chronic kidney disease - a systematic review and meta-analysisPLoS One117e015876510.1371/journal.pone.0158765
Htay, H., Johnson, D. W., Craig, J. C., Teixeira Pinto, A., Hawley, C. M. y Cho, Y. (2021). Urgent start peritoneal dialysis versus haemodialysis for people with chronic kidney disease. Cochrane Database of Systematic Review, 1(1): CD012899, enero 27. https://doi.org/10.1002/14651858.CD012899.pub2.
H. Htay D. W. Johnson J. C. Craig A. Teixeira Pinto C. M. Hawley Y. Cho 27012021Urgent start peritoneal dialysis versus haemodialysis for people with chronic kidney diseaseCochrane Database of Systematic Review11CD012899enero 2710.1002/14651858.CD012899.pub2
Hu, J., Odom, T. W. y Lieber, C. M. (1999). Chemistry and physics in one dimension: synthesis and properties of nanowires and nanotubes. Accounts of Chemical Research, 32(5): 435-445. https://doi.org/10.1021/ar9700365.
J. Hu T. W. Odom C. M. Lieber 1999Chemistry and physics in one dimension: synthesis and properties of nanowires and nanotubesAccounts of Chemical Research32543544510.1021/ar9700365
Huber, D. L. (2005). Synthesis, properties, and applications of iron nanoparticles. Small, 1(5): 482-501. https://doi.org/10.1002/smll.200500006.
D. L. Huber 2005Synthesis, properties, and applications of iron nanoparticlesSmall1548250110.1002/smll.200500006
INEGI (Instituto Nacional de Estadística y Geografía). (2023). Estadística de defunciones registradas de enero a junio 2022. Comunicado de prensa número 29: 1-40. https://www.inegi.org.mx/contenidos/saladeprensa/boletines/2024/EDR/EDR2023_En-Jn.pdf.
Instituto Nacional de Estadística y Geografía 2023Estadística de defunciones registradas de enero a junio 202229https://www.inegi.org.mx/contenidos/saladeprensa/boletines/2024/EDR/EDR2023_En-Jn.pdf
INSP (Instituto Nacional de Salud Pública). (2020). La enfermedad renal crónica en México. https://www.insp.mx/avisos/5296- enfermedad-renal-cronica-mexico.html.
Instituto Nacional de Salud Pública 2020La enfermedad renal crónica en Méxicohttps://www.insp.mx/avisos/5296- enfermedad-renal-cronica-mexico.html
Jha, V., García, G., Iseki, K., Li, Z., Naicker, S., Plattner, B. et al. (2013). Chronic kidney disease: global dimension and perspectives. The Lancet. 382(9888):260-72. https://doi.org/10.1016/S0140-6736(13)60687-X.
V. Jha G. García K. Iseki Z. Li S. Naicker B. Plattner 2013Chronic kidney disease: global dimension and perspectivesThe Lancet382988826027210.1016/S0140-6736(13)60687-X
Jiang, Q., Song, R., Xu, L., Tang, Y., Li, H., Cheng, Z. et al. (2020). Carbon -based nanomaterials for hemoperfusion: a mini-review. Frontiers in Chemistry, 8: 405. https://doi.org/10.3389/fchem.2020.00405.
Q. Jiang R. Song L. Xu Y. Tang H. Li Z. Cheng 2020Carbon -based nanomaterials for hemoperfusion: a mini-reviewFrontiers in Chemistry840510.3389/fchem.2020.00405
K/DOQI. (2002). Clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. National Kidney Foundation. Am J Kidney Dis, 39(suppl 1) 1: S1-266.
K/DOQI 2002Clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratificationNational Kidney Foundation. Am J Kidney Dis3911S1266
Kameda, T., Horikoshi, K., Kumagai, S., Saito, Y. y Yoshioka, T. (2020). Adsorption of urea, creatinine, and uric acid onto spherical activated carbon. Separation and Purification Technology, 237: 116367. https://doi.org/10.1016/j.seppur.2019.116367.
T. Kameda K. Horikoshi S. Kumagai Y. Saito T. Yoshioka 2020Adsorption of urea, creatinine, and uric acid onto spherical activated carbonSeparation and Purification Technology23711636710.1016/j.seppur.2019.116367
Kausar, A., Iqbal, M., Javed, A., Aftab, K., Nazli, Z. H., Bhatti, H. N. y Nouren, S. (2018). Dyes adsorption using clay and modified clay: a review. Journal of Molecular Liquids, 256: 395-407. https://doi.org/10.1016/j.molliq.2018.02.034.
A. Kausar M. Iqbal A. Javed K. Aftab Z. H. Nazli H. N. Bhatti S. Nouren 2018Dyes adsorption using clay and modified clay: a reviewJournal of Molecular Liquids25639540710.1016/j.molliq.2018.02.034
Kim, T., Hyeon, T. (2014). Applications of inorganic nanoparticles as therapeutic agents. Nanotechnology, 25(1): 012001. https://doi.org/10.1088/0957-4484/25/1/012001.
T. Kim T. Hyeon 2014Applications of inorganic nanoparticles as therapeutic agentsNanotechnology25101200110.1088/0957-4484/25/1/012001
Kotanko, P., Kuhlmann, M. K. y Levin, N. W. (2010). Hemodialysis: principles and techniques. En Comprehensive clinical nephrology, 4th ed. Elsevier, 1053-1059. https://doi.org/10.1016/B978-0-323-05876-6.00089-7.
P. Kotanko M. K. Kuhlmann N. W. Levin 2010Hemodialysis: principles and techniquesComprehensive clinical nephrology4Elsevier1053105910.1016/B978-0-323-05876-6.00089-7
Laurent, S., Forge, D., Port, M., Roch, A., Robic, C., Vander Elst, L. y Muller, R. N. (2008). Magnetic iron oxide nanoparticles: synthesis, stabilization, vectorization, physicochemical characterizations, and biological applications. Chemical Reviews, 108(6): 2064-2110. https://doi.org/10.1021/cr068445e.
S. Laurent D. Forge M. Port A. Roch C. Robic L. Vander Elst R. N. Muller 2008Magnetic iron oxide nanoparticles: synthesis, stabilization, vectorization, physicochemical characterizations, and biological applicationsChemical Reviews10862064211010.1021/cr068445e
Levey, A. S., Coresh, J. (2012) Chronic kidney disease. The Lancet, 379(9811): 165-180. https://doi.org/10.1016/S0140-6736(11)60178-5.
A. S. Levey J. Coresh 2012Chronic kidney diseaseThe Lancet379981116518010.1016/S0140-6736(11)60178-5
Li, J., Li, X., Wang, X., Ye, Q., Zhai, K. et al. (2017). Removal of uremic toxins by mesoporous silica nanoparticles. Scientific Reports, 7: 8809. https://doi.org/10.1038/s41598-017-09368-2.
J. Li X. Li X. Wang Q. Ye K. Zhai 2017Removal of uremic toxins by mesoporous silica nanoparticlesScientific Reports7880910.1038/s41598-017-09368-2
Li, J., Lu, Y., Ye, Q., Cinke, M., Han, J. y Meyyappan, M. (2003). Carbon nanotube sensors for gas and organic vapor detection. Nano letters, 3(7): 929-933. https://doi.org/10.1021/nl034220x.
J. Li Y. Lu Q. Ye M. Cinke J. Han M. Meyyappan 2003Carbon nanotube sensors for gas and organic vapor detectionNano letters3792993310.1021/nl034220x
Liabeuf, S., Barreto, D. V., Barreto, F. C., Meert, N., Glorieux, G., Schepers, E. et al. (2010). Free p-cresylsulphate is a predictor of mortality in patients at different stages of chronic kidney disease. Nephrol Dial Transplant. 25(4): 1183-1191. https://doi.org/10.1093/ndt/gfp592.
S. Liabeuf D. V. Barreto F. C. Barreto N. Meert G. Glorieux E. Schepers 2010Free p-cresylsulphate is a predictor of mortality in patients at different stages of chronic kidney diseaseNephrol Dial Transplant2541183119110.1093/ndt/gfp592
Liabeuf, S., Glorieux, G., Lenglet, A., Diouf, M., Schepers, E., Desjardins, L. et al. (2013). Does p-cresylglucuronide have the same impact on mortality as other protein-bound uremic toxins? PLoS One. 8(6): e67168. https://doi.org/10.1371/journal.pone.0067168.
S. Liabeuf G. Glorieux A. Lenglet M. Diouf E. Schepers L. Desjardins 2013Does p-cresylglucuronide have the same impact on mortality as other protein-bound uremic toxins?PLoS One86e6716810.1371/journal.pone.0067168
Lijima, S. (1991). Helical microtubules of graphitic carbon. Nature, 354(6348): 56-58. https://doi.org/10.1038/354056a0.
S. Lijima 1991Helical microtubules of graphitic carbonNature3546348565810.1038/354056a0
Lin, Y. S., Hurley, K. R., Haynes, C. L. (2012). Critical considerations in the biomedical use of mesoporous silica nanoparticles. Journal of Physical Chemistry Letters, 3(3): 364-374. https://doi.org/10.1021/jz2015164.
Y. S. Lin K. R. Hurley C. L. Haynes 2012Critical considerations in the biomedical use of mesoporous silica nanoparticlesJournal of Physical Chemistry Letters3336437410.1021/jz2015164
Lin, Y., Xu, Z., Wang, Z., Wang, L., Lin, J., Yao, C. et al. (2016). Efficient removal of uremic toxin by functionalized nanoporous carbon: an in vitro study. ACS Applied Materials & Interfaces, 8(7): 4703-4711. https://doi.org10.1021/acsami.5b12122.
Y. Lin Z. Xu Z. Wang L. Wang J. Lin C. Yao 2016Efficient removal of uremic toxin by functionalized nanoporous carbon: an in vitro studyACS Applied Materials & Interfaces874703471110.1021/acsami.5b12122
Liu, Y., Peng, X., Hu, Z., Yu, M., Fu, J. y Huang, Y. (2021). Fabrication of a novel nitrogen-containing porous carbon adsorbent for protein-bound uremic toxins removal. Materials Science and Engineering: C, 121: 111879. https://doi.org/10.1016/j.msec.2021.111879.
Y. Liu X. Peng Z. Hu M. Yu J. Fu Y. Huang 2021Fabrication of a novel nitrogen-containing porous carbon adsorbent for protein-bound uremic toxins removalMaterials Science and Engineering: C12111187910.1016/j.msec.2021.111879
López, D. E. (2008). Enfermedad renal crónica; definición y clasificación. El Residente, 3(3): 73-78. https://www.medigraphic.com/pdfs/residente/rr-2008/rr083b.pdf.
D. E. López 2008Enfermedad renal crónica; definición y clasificaciónEl Residente337378https://www.medigraphic.com/pdfs/residente/rr-2008/rr083b.pdf
Lu, J., Liong, M., Zink, J. I., Tamanoi, F. (2007). Mesoporous silica nanoparticles as a delivery system for hydrophobic anticancer drugs. Small, 3(8): 1341-1346. https://doi.org10.1002/smll.200700012.
J. Lu M. Liong J. I. Zink F. Tamanoi 2007Mesoporous silica nanoparticles as a delivery system for hydrophobic anticancer drugsSmall381341134610.1002/smll.200700012
Lythe, J. E., Xue, H., Lynch, K. E., Curhan, G. C., Brunelli, S. M. (2015). Association of mortality risk with various definitions of intradialytic hypotension. Journal of the American Society of Nephrology, 26(3): 724-34. https://doi.org10.1681/ASN.2014020187.
J. E. Lythe H. Xue K. E. Lynch G. C. Curhan S. M. Brunelli 2015Association of mortality risk with various definitions of intradialytic hypotensionJournal of the American Society of Nephrology26372473410.1681/ASN.2014020187
Malik, D. J., Warwick, G. L., Mathieson, I., Hoenich, N. A. y Streat, M. (2005). Structured carbon haemoadsorbents for the removal of middle molecular weight toxins. Carbon, 43(11): 2317-2329. https://doi.org/10.1016/j.carbon.2005.04.038A.
D. J. Malik G. L. Warwick I. Mathieson N. A. Hoenich M. Streat 2005Structured carbon haemoadsorbents for the removal of middle molecular weight toxinsCarbon43112317232910.1016/j.carbon.2005.04.038A
Malik, S., Muhammad, K. y Waheed, Y. (2023). Nanotechnology: a revolution in modern industry. Molecules, 28(2): 661. https://doi.org/10.3390/molecules28020661.
S. Malik K. Muhammad Y. Waheed 2023Nanotechnology: a revolution in modern industryMolecules28266110.3390/molecules28020661
Malo, M. A. y De Francisco, A. L. M. (2010). Dializadores y membranas de diálisis. Nefrología al día. Madrid: Grupo Editorial Nefrología de la Sociedad Española de Nefrología, 425-435.
M. A. Malo A. L. M. De Francisco 2010Dializadores y membranas de diálisis. Nefrología al díaMadridGrupo Editorial Nefrología de la Sociedad Española de Nefrología425435
Miardan, L. N., Rezaii, E., Mahkam, M. y Khosroshahi, H. T. (2023). Synthesis of mesoporous silica nanoparticles linked by molecularly imprinted polymers and examination of their ability to remove uremic toxins. Journal of Porous Materials, 30(6): 1995-2010. https://doi.org/10.1007/s10934-023-01480-w.
L. N. Miardan E. Rezaii M. Mahkam H. T. Khosroshahi 2023Synthesis of mesoporous silica nanoparticles linked by molecularly imprinted polymers and examination of their ability to remove uremic toxinsJournal of Porous Materials3061995201010.1007/s10934-023-01480-w
Mosavi, S. H. y Zare-Dorabei, R. (2023). Synthesis of an IRMOF-1@SiO 2 core-shell and amino-functionalization with APTES for the adsorption of urea and creatinine using a fixed-bed column study. Langmuir, 39(18): 6623-6636. https://doi.org/10.1021/acs.langmuir.3c00632.
S. H. Mosavi R. Zare-Dorabei 2023Synthesis of an IRMOF-1@SiO 2 core-shell and amino-functionalization with APTES for the adsorption of urea and creatinine using a fixed-bed column studyLangmuir39186623663610.1021/acs.langmuir.3c00632
Mosleh-Shirazi, S., Abbasi, M., Moaddeli, M. Reza, Vaez, A., Shafiee, M., Kasaee, S. R., Amani, A. M. y Hatam, S. (2022). Nanotechnology advances in the detection and treatment of cancer: an overview. Nanotheranostics, 6(4): 400-423. https://doi.org/10.7150/ntn.74613.
S. Mosleh-Shirazi M. Abbasi M. Reza Moaddeli A. Vaez M. Shafiee S. R. Kasaee A. M. Amani S. Hatam 2022Nanotechnology advances in the detection and treatment of cancer: an overviewNanotheranostics6440042310.7150/ntn.74613
Nguyen, C. H., Fu, C.-C., Chen, Z.-H., Tran, T. T. Van, Liu, S.-H. y Juang, R.-S. (2021). Enhanced and selective adsorption of urea and creatinine on amine-functionalized mesoporous silica SBA-15 via hydrogen bonding. Microporous and Mesoporous Materials, 311: 110733. https://doi.org/10.1016/j.micromeso.2020.110733.
C. H. Nguyen C.-C. Fu Z.-H. Chen T. T. Van Tran S.-H. Liu R.-S. Juang 2021Enhanced and selective adsorption of urea and creatinine on amine-functionalized mesoporous silica SBA-15 via hydrogen bondingMicroporous and Mesoporous Materials31111073310.1016/j.micromeso.2020.110733
Niang, A., Iyengar, A. y Luyckx, V. A. (2018). Hemodialysis versus peritoneal dialysis in resource limited settings. Current Opinion in Nephrology and Hypertension, 27(6): 463-471. https://doi.org/10.1097/MNH.0000000000000455.
A. Niang A. Iyengar V. A. Luyckx 2018Hemodialysis versus peritoneal dialysis in resource limited settingsCurrent Opinion in Nephrology and Hypertension27646347110.1097/MNH.0000000000000455
Novoselov, K. S., Geim, A. K., Morozov, S. V., Jiang, D., Zhang, Y., Dubonos, S. V. y Firsov, A. A. (2004). Electric field effect in atomically thin carbon films. Science, 306(5696): 666-669. https://doi.org/10.1126/science.1102896.
K. S. Novoselov A. K. Geim S. V. Morozov D. Jiang Y. Zhang S. V. Dubonos A. A. Firsov 2004Electric field effect in atomically thin carbon filmsScience306569666666910.1126/science.1102896
OMS (Organización Mundial de la Salud). (2020). Las 10 principales causas de muerte. https://www.who.int/news-room/fact-sheets/detail/thetop-10-causes-of-death.
Organización Mundial de la Salud 2020Las 10 principales causas de muertehttps://www.who.int/news-room/fact-sheets/detail/thetop-10-causes-of-death
Ooi, C. H., Cheah, W. K. y Yeoh, F. Y. (2019). Comparative study on the urea removal by different nanoporous materials. Adsorption, 25(6): 1169-1175. https://doi.org/10.1007/s10450-019-00130-5.
C. H. Ooi W. K. Cheah F. Y. Yeoh 2019Comparative study on the urea removal by different nanoporous materialsAdsorption2561169117510.1007/s10450-019-00130-5
Padilla-Osuna, I. y Escobar-Leal, G. (2017). Alteraciones en el eje intestino-riñón durante la enfermedad renal crónica: causas, consecuencias y propuestas de tratamiento. https://dx.doi.org/10.14306/renhyd.21.2.244.
I. Padilla-Osuna G. Escobar-Leal 2017Alteraciones en el eje intestino-riñón durante la enfermedad renal crónica: causas, consecuencias y propuestas de tratamiento10.14306/renhyd.21.2.244
Pavlenko, D., Giasafaki, D., Charalambopoulou, G., Van Geffen, E., Gerritsen, K. G. F., Steriotis, T. y Stamatialis, D. (2017). Carbon adsorbents with dual porosity for efficient removal of uremic toxins and cytokines from human plasma. Scientific Reports, 7(1): 14914. https://doi.org/10.1038/s41598-017-15116-y.
D. Pavlenko D. Giasafaki G. Charalambopoulou E. Van Geffen K. G. F. Gerritsen T. Steriotis D. Stamatialis 2017Carbon adsorbents with dual porosity for efficient removal of uremic toxins and cytokines from human plasmaScientific Reports711491410.1038/s41598-017-15116-y
Rai, M., Yadav, A. y Gade, A. (2009). Silver nanoparticles as a new generation of antimicrobials. Biotechnology Advances, 27(1): 76-83. https://doi.org/10.1016/j.biotechadv.2008.09.002.
M. Rai A. Yadav A. Gade 2009Silver nanoparticles as a new generation of antimicrobialsBiotechnology Advances271768310.1016/j.biotechadv.2008.09.002
Roco, M. C. (2003). Broader societal issues of nanotechnology. Journal of Nanoparticle Research, 5(3-4): 181-189. https://doi.org/10.1023/A:1025548512438.
M. C. Roco 2003Broader societal issues of nanotechnologyJournal of Nanoparticle Research53-418118910.1023/A:1025548512438
Ronco, C., Breuer, B., Bowry, S. K. (2006) Hemodialysis membranes for high-volume hemodialytic therapies: the application of nanotechnology. Hemodial Int., 10: 48-50. https://doi.org/10.1111/j.1542-4758.2006.01191.x.
C. Ronco B. Breuer S. K. Bowry 2006Hemodialysis membranes for high-volume hemodialytic therapies: the application of nanotechnologyHemodial Int.10485010.1111/j.1542-4758.2006.01191.x
Sanders, I. J., Peeten, T. L. (2011). Carbon black: production, properties, and uses. Chemical Engineering Methods and Technology, 250-255. Nova Science Publishers. https://books.google.com.mx/books?id=we03YgEACAAJ.
I. J. Sanders T. L. Peeten 2011Carbon black: production, properties, and usesChemical Engineering Methods and Technology250255Nova Science Publishershttps://books.google.com.mx/books?id=we03YgEACAAJ
Saran, R., Bragg, J. L., Levin, N. W. et al. (2006). Longer treatment time and slower ultrafiltration in hemodialysis: associations with reduced mortality in the DOPPS. Kidney International. 69(7): 1222-8. https://doi.org/10.1038/sj.ki.5000164.
R. Saran J. L. Bragg N. W. Levin 2006Longer treatment time and slower ultrafiltration in hemodialysis: associations with reduced mortality in the DOPPSKidney International6971222122810.1038/sj.ki.5000164
Schwierz, F. (2010). Graphene transistors. Nature Nanotechnology, 5(7): 487-496. https://doi.org/10.1038/nnano.2010.89.
F. Schwierz 2010Graphene transistorsNature Nanotechnology5748749610.1038/nnano.2010.89
Sharif Sh., M., Golestani Fard, F., Khatibi, E. y Sarpoolaky, H. (2009). Dispersion and stability of carbon black nanoparticles, studied by ultraviolet-visible spectroscopy. Journal of the Taiwan Institute of Chemical Engineers, 40(5): 524-527. https://doi.org/10.1016/j.jtice.2009.03.006.
M. Sharif Sh. F. Golestani Fard E. Khatibi H. Sarpoolaky 2009Dispersion and stability of carbon black nanoparticles, studied by ultraviolet-visible spectroscopyJournal of the Taiwan Institute of Chemical Engineers40552452710.1016/j.jtice.2009.03.006
Shoueir, K., Wahba, A. M., El Marouazi, H. y Janowska, I. (2023). Performant removal of creatinine using few-layer-graphene/alginate beads as a kidney filter. International Journal of Biological Macromolecules, 242: 124936. https://doi.org/10.1016/j.ijbiomac.2023.124936.
K. Shoueir A. M. Wahba H. El Marouazi I. Janowska 2023Performant removal of creatinine using few-layer-graphene/alginate beads as a kidney filterInternational Journal of Biological Macromolecules24212493610.1016/j.ijbiomac.2023.124936
Sperling, R. A., Rivera Gil, P., Zhang, F., Zanella, M. y Parak, W. J. (2008). Biological applications of gold nanoparticles. Chemical Society Reviews, 37(9): 1896-1908. https://doi.org/10.1039/B712170A.
R. A. Sperling P. Rivera Gil F. Zhang M. Zanella W. J. Parak 2008Biological applications of gold nanoparticlesChemical Society Reviews3791896190810.1039/B712170A
Vanholder, R., De Smet, R., Glorieux, G., Argilés, A., Baurmeister, U., Brunet, P. et al. (2003). Review on uremic toxins: classification, concentration, and interindividual variability. Kidney Int. 63(5): 1934-1943. https://doi.org/10.1046/j.1523-1755.2003.00924.x.
R. Vanholder R. De Smet G. Glorieux A. Argilés U. Baurmeister P. Brunet 2003Review on uremic toxins: classification, concentration, and interindividual variabilityKidney Int6351934194310.1046/j.1523-1755.2003.00924.x
Wang, Y., Wang, L., Chen, H., Liang, J., He, F., Zhang, L. et al. (2021). Three-dimensional nanoporous graphene-based material for the removal of uremic toxins: a biocompatible and efficient adsorbent. Chemical Engineering Journal, 404: 127090. https://doi.org/10.1016/j.cej.2020.127090.
Y. Wang L. Wang H. Chen J. Liang F. He L. Zhang 2021Three-dimensional nanoporous graphene-based material for the removal of uremic toxins: a biocompatible and efficient adsorbentChemical Engineering Journal40412709010.1016/j.cej.2020.127090
Wang, Y., Zhao, Q., Han, N., Bai, L., Li, J., Liu, J. et al. (2015). Mesoporous silica nanoparticles in drug delivery and biomedical applications. Nanomedicine: Nanotechnology, Biology and Medicine. 11(2): 313-327. https://doi.org/10.1016/j.nano.2014.09.014.
Y. Wang Q. Zhao N. Han L. Bai J. Li J. Liu 2015Mesoporous silica nanoparticles in drug delivery and biomedical applicationsNanomedicine: Nanotechnology, Biology and Medicine11231332710.1016/j.nano.2014.09.014
Waring, M. S. y Wells, J. R. (2015). Volatile organic compound conversion by ozone, hydroxyl radicals, and nitrate radicals in residential indoor air: magnitudes and impacts of oxidant sources. Atmospheric Environment, 106: 382-391. https://doi.org/10.1016/j.atmosenv.2014.06.062.
M. S. Waring J. R. Wells 2015Volatile organic compound conversion by ozone, hydroxyl radicals, and nitrate radicals in residential indoor air: magnitudes and impacts of oxidant sourcesAtmospheric Environment10638239110.1016/j.atmosenv.2014.06.062
Webster, A. C., Nagler, E. V., Morton, R. L., Masson, P. (2017). Chronic kidney disease. The Lancet, 389(10075): 1238-52. https://doi.org/10.1016/S0140-6736(16)32064-5.
A. C. Webster E. V. Nagler R. L. Morton P. Masson 2017Chronic kidney diseaseThe Lancet389100751238125210.1016/S0140-6736(16)32064-5
World Kidney Day. (2023). Spanish translation. http://www.worldkidneyday.org.
World Kidney Day 2023Spanish translationhttp://www.worldkidneyday.org
Yang, I.-H., Szabó, L., Sasaki, M., Uto, K., Henzie, J., Lin, F.-H., Samitsu, S. y Ebara, M. (2023). Biobased chitosan-derived self-nitrogen-doped porous carbon nanofibers containing nitrogen-doped zeolites for efficient removal of uremic toxins during hemodialysis. International Journal of Biological Macromolecules, 253: 126880. https://doi.org/10.1016/j.ijbiomac.2023.126880.
I.-H. Yang L. Szabó M. Sasaki K. Uto J. Henzie F.-H. Lin S. Samitsu M. Ebara 2023Biobased chitosan-derived self-nitrogen-doped porous carbon nanofibers containing nitrogen-doped zeolites for efficient removal of uremic toxins during hemodialysisInternational Journal of Biological Macromolecules25312688010.1016/j.ijbiomac.2023.126880
Yantasee, W., Rutledge, R. D., Chouyyok, W., Sukwarotwat, V., Orr, G., Warner, C. L., Warner, M. G., Fryxell, G. E., Wiacek, R. J., Timchalk, C. y Addleman, R. S. (2010). Functionalized nanoporous silica for the removal of heavy metals from biological systems: adsorption and application. ACS Applied Materials & Interfaces, 2(10): 2749-2758. https://doi.org/10.1021/am100616b.
W. Yantasee R. D. Rutledge W. Chouyyok V. Sukwarotwat G. Orr C. L. Warner M. G. Warner G. E. Fryxell R. J. Wiacek C. Timchalk R. S. Addleman 2010Functionalized nanoporous silica for the removal of heavy metals from biological systems: adsorption and applicationACS Applied Materials & Interfaces2102749275810.1021/am100616b
Ye, C., Gong, Q., Lu, F. y Liang, J. (2007). Adsorption of uraemic toxins on carbon nanotubes. Separation and Purification Technology, 58(1): 2-6. https://doi.org/10.1016/j.seppur.2007.07.003.
C. Ye Q. Gong F. Lu J. Liang 2007Adsorption of uraemic toxins on carbon nanotubesSeparation and Purification Technology5812610.1016/j.seppur.2007.07.003
Yu, X., Shen, L., Li, X., Wang, X., Zhu, M., Hsiao S. (2017). High performance thin-film nanofibrous composite hemodialysis membranes with efficient middle-molecule uremic toxic removal. Journal of MembranesScience, 523: 173-184. https://doi.org/10.1016/j.memsci.2016.09.057.
X. Yu L. Shen X. Li X. Wang M. Zhu S. Hsiao 2017High performance thin-film nanofibrous composite hemodialysis membranes with efficient middle-molecule uremic toxic removalJournal of MembranesScience52317318410.1016/j.memsci.2016.09.057
Zhang, Y., Zhang, S., Liu, J., Huang, J., Fan, Q. et al. (2016). Silica nanoparticles as efficient removal agents for uremic toxins: towards a sorbent-based dialysis treatment. Small, 12(40): 5555-5562. https://doi.org/10.1002/smll.201601846.
Y. Zhang S. Zhang J. Liu J. Huang Q. Fan 2016Silica nanoparticles as efficient removal agents for uremic toxins: towards a sorbent-based dialysis treatmentSmall12405555556210.1002/smll.201601846
Zhang, M., Atkinson, K. R. y Baughman, R. H. (2004). Multifunctional carbon nanotube yarns by downsizing an ancient technology. Science, 306(5700): 1358-1361. https://doi.org/10.1126/science.1104276.
M. Zhang K. R. Atkinson R. H. Baughman 2004Multifunctional carbon nanotube yarns by downsizing an ancient technologyScience30657001358136110.1126/science.1104276
Zhang, Y., Sun, H., Yu, H., Liang, J., Zhang, F. et al. (2021). Nanomaterials for the removal of uremic toxins from dialysate: a comprehensive review. Materials Science and Engineering: C., 128: 112336. https://doi.org/10.1016/j.msec.2021.112336.
Y. Zhang H. Sun H. Yu J. Liang F. Zhang 2021Nanomaterials for the removal of uremic toxins from dialysate: a comprehensive reviewMaterials Science and Engineering: C12811233610.1016/j.msec.2021.112336
Zheng, K., Setyawati, M. I., Lim, T. P., Leong, D. T., Xie, J. (2016). Antimicrobial cluster bombs: silver nanoclusters packed with daptomycin. ACS Nano, 10(8): 7934-7942. https://doi.org/10.1021/acsnano.6b03602.
K. Zheng M. I. Setyawati T. P. Lim D. T. Leong J. Xie 2016Antimicrobial cluster bombs: silver nanoclusters packed with daptomycinACS Nano1087934794210.1021/acsnano.6b03602