Introducción
Las infecciones nosocomiales o infecciones asociadas con la atención a la salud (IAAS) son aquellas que se adquieren en el proceso de recibir o brindar atención médica en un recinto de atención a la salud como hospitales, clínicas y consultorios. Son consideradas como un problema de salud pública por la Organización Mundial de la Salud (OMS) debido a las altas tasas de morbilidad y mortalidad, y a las implicaciones económicas y sociales. Al mismo tiempo, el incremento de bacterias resistentes a los antibióticos agrava este problema. Pacientes de todo el mundo se ven afectados por infecciones nosocomiales, aunque en los países desarrollados la prevalencia es menor a la de los países en desarrollo. La prevalencia en países desarrollados, entre 1995 y 2010, se estima en 7.6% de los pacientes ingresados a un hospital (OMS 2022), mientras en países en desarrollo se estima en 15.5%, entre 1996 y 2008 (Allegranzi et al., 2011).
En México, la Red Hospitalaria de Vigilancia Epidemiológica (RHOVE) de la Secretaría de Salud cuenta con la Norma Oficial Mexicana (NOM-045- SSA2-2005) para la vigilancia epidemiológica, prevención y control de las infecciones nosocomiales. En su informe de 2022, la RHOVE reportó que, de enero a agosto de ese año, se notificaron 36,425 infecciones nosocomiales a nivel nacional, con una tasa de letalidad de 5%. Las áreas hospitalarias en las cuales las infecciones nosocomiales se adquirieron con mayor frecuencia fueron medicina interna, cirugía general y las unidades de terapia intensiva, siendo las infecciones más frecuentes en vías urinarias y torrente sanguíneo relacionadas con el uso de catéteres, bacteriemia primaria, e infecciones en piel y tejidos blandos (Gómez Muñoz et al., 2023). Las infecciones nosocomiales ocurren por la exposición a una gran variedad de microrganismos patógenos u oportunistas; además, existen condiciones favorecedoras de su desarrollo como un sistema inmune reducido, ventilación insuficiente, desinfección deficiente, hacinamiento, estancias hospitalarias prolongadas y procedimientos médicos invasivos.
Los microrganismos asociados con mayor frecuencia a las infecciones nosocomiales son las bacterias, seguidas de hongos y virus. En la Tabla 1 se enlistan los principales microrganismos aislados de infecciones nosocomiales en recintos en México, Estados Unidos, y países en desarrollo. Se observa que las especies bacterianas encontradas en las tres regiones son Staphylococcus aureus (S. aureus), Escherichia coli (E. coli) y Pseudomonas aeruginosa (P. aeruginosa), por otra parte, las especies fúngicas más comunes fueron las del género Candida spp. Particularmente en México, la especie Staphylococcus epidermidis (S. epidermidis) también se encuentra entre las bacterias nosocomiales más frecuentes.
Tabla 1
Microrganismos aislados de infecciones nosocomiales en México, Estados Unidos y países en desarrollo, en orden de frecuencia
| Microrganismos aislados en México* | Microrganismos aislados en Estados Unidos⧫ | Microrganismos aislados en países en desarrollo◊ |
|---|---|---|
| Escherichia coli | Clostridium difficile | Staphylococcus aureus |
|
Pseudomonas aeruginosa Klebsiella pneumoniae Acinetobacter baumannii Staphylococcus aureus Staphylococcus epidermidis Candida albicans Enterobacter cloacae Otros |
Staphylococcus aureus Klebsiella pneumoniae Escherichia coli Enterococcus spp Pseudomonas aeruginosa Candida spp Streptococcus spp Otros |
Staphylococcus coagulasa negativo Enterococcus spp Escherichia coli Enterobacteriaceae (incluyendo E. coli) Pseudomonas spp Acinetobacter spp Candida spp Otros |
[i] *Datos reportados de enero a agosto de 2022 (Gómez Muñoz et al., 2023). ⧫Datos reportados de 2011 (Magill et al., 2014). ◊Datos reportados de 1995 a 2008 (Allegranzi et al., 2011).
Las bacterias son capaces de formar biopelículas en los tejidos, dispositivos médicos y otras superficies. Las biopelículas son comunidades de bacterias fuertemente asociadas entre sí que se adhieren a superficies en un ambiente húmedo y crecen envueltas en una matriz polimérica producida por ellas mismas (Costerton et al., 1999). La matriz está compuesta en mayor medida de polisacáridos y agua, y en menor medida de proteínas y moléculas de ácido desoxirribonucleico (ADN) (Flemming y Wingender, 2010). Esta conformación proporciona a las bacterias protección contra los mecanismos de defensa del huésped y contra agentes antimicrobianos como los antibióticos, lo cual dificulta su tratamiento.
Por lo anterior, es esencial implementar medidas para prevenir y controlar la propagación de los microrganismos responsables de las infecciones nosocomiales. Para abordar esta problemática, una de las nuevas alternativas incluidas a explorar por investigadores de todo el mundo, y también por nuestro grupo de trabajo, es el uso de nanopartículas (NPs) de compuestos inorgánicas como metales de transición, óxidos metálicos y sales con el potencial de inhibir el crecimiento bacteriano. Los compuestos en nanoescala, es decir, con dimensiones de 1 a 100 nm (1 nm = 1 × 10-9 m), suelen tener un efecto antibacteriano superior respecto al mismo compuesto en bulto, por su mayor superficie por unidad de volumen, haciéndolas más reactivas y otorgándoles el potencial de interactuar con los microrganismos y así afectar su comportamiento con precisión sin precedentes. Algunas de las potenciales ventajas del uso de NPs con propiedades antibacterianas sobre los antibióticos es que las bacterias no parecen generar una rápida resistencia a ellas, posiblemente por sus mecanismos de acción, como lo son: el daño mecánico a la superficie bacteriana, las fuertes interacciones electrostáticas entre moléculas de las bacterias y iones de las NPs que desestabilizan funciones vitales de las bacterias, la generación de estrés oxidativo por diferentes vías, por mencionar algunos. Además, el uso de nanopartículas permite reducir la dosis y con ello, los posibles efectos secundarios en el paciente.
Algunos de los compuestos utilizados como agentes antibacterianos son aquellos a base de bismuto. El bismuto (Bi) es un elemento metálico perteneciente al grupo 15 (familia VA) de la tabla periódica, tiene un número atómico (Z) de 83, una masa atómica de 208.98 g/mol, y estados de oxidación +3 y +5, por lo que actúa como agente reductor. Posee un punto de ebullición de 271.40 ºC, un punto de fusión de 1564 ºC y una energía de ionización de 7.289 eV, por lo cual es un compuesto químicamente estable en condiciones estándar de presión y temperatura (Habashi, 2013). De acuerdo con el Sistema Integral sobre Economía Minera (SIEM) del gobierno de México, en 2018 nuestro país ocupó el 4to lugar en la producción de Bi a nivel mundial, produciendo entre 18 y 30 toneladas mensuales, siendo el estado de Coahuila el principal productor. En Estados Unidos, aproximadamente el 60% del consumo de Bi se destina a aplicaciones cosméticas, de laboratorio y farmacéuticas (USGS, 2021). El Bi se ha utilizado en el área médica por más de 250 años para el tratamiento de diversas enfermedades, principalmente para trastornos gastrointestinales como diarrea, gastritis y colitis ocasionados por la presencia de Helicobacter pylori (Bagchi et al., 1999; Koulinska et al., 2018; Lambert y Midolo, 1997; Yakoob et al., 2014). Asimismo, las sales derivadas del Bi como el subsalicilato de bismuto (SSBi), subcitrato de Bi coloidal y citrato de Bi han demostrado su efectividad como agentes antimicrobianos; por ejemplo, el salicilato de Bi es capaz de inhibir el crecimiento de diferentes bacterias y de levaduras patógenas incluyendo Candida albicans (Alharbi et al., 2012; Cornick et al., 1990; Kappstein y Engels, 1987; Pitz et al., 2015).
Recientemente, se realizó un estudio comparativo in vitro de la actividad antimicrobiana de diferentes compuestos de Bi contra diferentes bacterias de importancia médica, demostrando que el SSBi fue el más eficaz en la inhibición del crecimiento de estos microrganismos, seguido del trióxido de Bi y el subgalato de Bi (Vega-Jiménez A et al., 2012).
El SSBi es una sal básica de ácido salicílico unido a un catión de bismuto trivalente, cuya fórmula química es C7H5BiO4 (Figura 1). Es un polvo blanquecino con un peso molecular de 363.00701 g/mol, una densidad de 0.43 g/cm3, y cada molécula contiene 58% de bismuto y 42% de salicilato en peso (Budavari, 1996). Esta sal básica se obtiene a partir del salicilato de bismuto por medio de hidrólisis, es soluble en ácidos, alcalinos y aceites, e insoluble en agua (< 1 mg/ml a 22 ºC) y alcohol (Arena, 1974; Lewis, 2007). Es considerado como moderadamente tóxico con una probable dosis letal oral en humanos de 0.5- 5 g/kg (Gosselin, 1976).
Figura 1
Estructura química del subsalicilato de bismuto
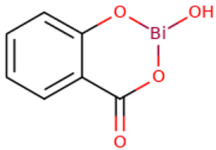
Fuente: Imagen tomada de (toxnet.nlm.nih.gov).
Los compuestos inorgánicos antibacterianos en forma de NPs podrían ser usados para desarrollar nuevos materiales con propiedades antimicrobianas, principalmente por su estabilidad química y la posibilidad de ser sintetizadas por métodos tanto descendentes (top-down) como ascendentes (buttom-up). Uno de los procedimientos top-down más eficientes para la obtención de NPs en suspensión coloidal es la técnica de ablación láser de sólidos en líquidos (ALSL) (Mafune et al., 2000).
La técnica de ALSL consiste en irradiar con luz láser de alta potencia un blanco sólido sumergido en un líquido, el blanco está compuesto del material del cual se busca obtener las NPs, y al absorber la radiación, se funde y ioniza el vapor del material. Después, se forma un plasma, el cual se condensa rápidamente en el líquido, y, simultáneamente, se produce una gran cantidad de partículas neutras de diferentes tamaños, micro y nano. Las partículas grandes tienden a sedimentarse en el fondo del recipiente, mientras que las NPs quedan en suspensión coloidal. Este procedimiento físico tiene ventajas como síntesis sencilla, facilidad para el montaje experimental, control del tamaño y concentración de las NPs; además, no utiliza precursores químicos tóxicos para su elaboración, obteniéndose NPs libres de contaminantes y residuos (Ibrahimkutty et al., 2015; Semaltianos et al., 2016; Yang, 2012).
En este trabajo, se obtuvieron NPs de subsalicilato de bismuto (NPs-SSBi) en suspensión coloidal por la técnica top-down de ablación láser de sólidos en líquidos, y se estudió su efecto antibacteriano usando cuatro bacterias frecuentemente asociadas con infecciones nosocomiales: E. coli, P. aeruginosa, S. aureus y S. epidermidis.
Materiales y metodología
Obtención de las nanopartículas de subsalicilato de bismuto (NPs-SSBi)
Las NPs-SSBi se obtuvieron mediante la técnica de ablación láser de sólidos inmersos en líquidos (ALSL), siguiendo los parámetros previamente reportados por nuestro grupo de trabajo (Reyes-Carmona et al., 2023), descritos en la Tabla 2. Brevemente: se utilizó un láser de Neodimio: YAG (Nd:YAG) dirigido a través de una serie de espejos hacia una lente para enfocar la luz hacia la superficie de una pastilla de SSBi, obtenida por compactación del polvo, inmersa en medio líquido (agua estéril). La pastilla se encontraba en movimiento rotatorio (15 rpm) para lograr irradiar diferentes zonas de la superficie de la pastilla. Una vez que el láser hizo contacto con el blanco de SSBi, se formó un plasma condensándose rápidamente dentro del agua, produciendo la suspensión coloidal de las NPs-SSBi. El principio y el montaje experimental se muestran en la Figura 2.
Tabla 2
Parámetros del proceso de ablación láser utilizados para obtener las NPs-SSBi.
Figura 2
Representación del montaje experimental de la formación de NPs-SSBi.
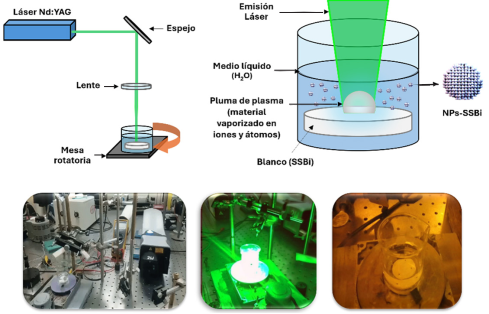
Fuente: Imagen tomada de (toxnet.nlm.nih.gov).
Caracterización de las NPs-SSBi
Por medio de espectroscopía ultravioleta-visible (UV-Vis) se identificó la presencia y estabilidad de las NPs-SSBi en suspensión comparadas con el SSBi en bulto. Se utilizó un espectrofotómetro LAMBDA UV/Vis/NIR (PerkinElmer®) en la longitud de onda de 200-600 nm, y agua estéril como línea base. Para analizar la estabilidad de la suspensión coloidal, se hicieron mediciones a 1, 7 y 21 días.
Para calcular la concentración de las de las NPs-SSBi se realizó una curva de calibración, siguiendo la metodología previamente descrita (Flores-Castañeda et al., 2019). Se preparó una solución stock de SSBi en ácido acético y agua (1:1) a partir de la cual se hicieron diluciones conocidas. Posteriormente, se midió la absorbancia de las diferentes suspensiones y se tomó el pico máximo de absorción (296 nm) como absorbancia de referencia para obtener la curva concentración vs absorbancia (figura suplementaria). Para determinar la concentración de las NPs-SSBi en cada muestra en suspensión coloidal, se midió la absorbancia de las muestras con y sin la dilución de ácido acético:agua (1:1) y se relacionó con la curva de calibración.
Figura Suplementaria
Se muestran las curvas de calibración elaboradas para determinar la concentración de las NPs-SSB.
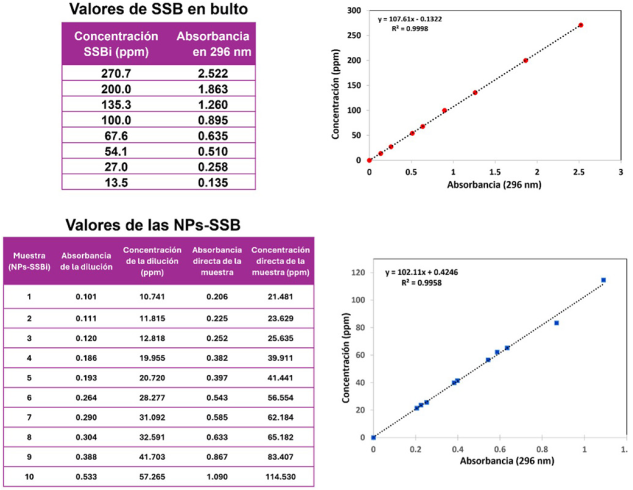
La parte superior, corresponde a los valores de concentración y absorbancia SSBi en bulto, que posteriormente fueron relacionados para crear la segunda curva de calibración con las NPs-SSBi, en ambos casos se obtuvieron valores de R2 mayores a 99.
Fuente: Elaboración de los autores.
El tamaño, morfología y factor de forma de las NPs-SSBi se analizaron mediante microscopía electrónica de transmisión (TEM). Se utilizó un microscopio electrónico de transmisión (JEOL-2010 operado a 200 kV). Y las distancias interplanares se determinaron utilizando TEM de alta resolución (HRTEM) y el análisis de datos mediante el software Digital Micrograph de GATAN.
Evaluación antibacteriana
Los ensayos antibacterianos se llevaron a cabo utilizando cepas tipo (American Type Cell Culture Collection, ATCC) de cuatro especies bacterianas nosocomiales Escherichia coli (ATCC 33780), Pseudomonas aeruginosa (ATCC 43536), Staphylococcus aureus (ATCC 25923), Staphylococcus epidemidis (ATCC 14990) (dos Gram negativas y dos Gram positivas). Las cepas aerobias se cultivaron individualmente en placas con agar de soya tripticasa (TSA) (BBL, Becton-Dickinson) y se incubaron durante 24 h a 35 ºC. Posteriormente, los cultivos puros de cada una de las diferentes especies bacterianas fueron transferidos a tubos de microcentrífuga con medio de cultivo caldo de soya tripticaseína (TSB). La densidad óptica (OD) de cada tubo se ajustó a 1 utilizando una longitud de onda de λ = 600 nm en un espectrofotómetro (BioPhotometer D30, Eppendorf) para obtener una suspensión bacteriana a una concentración de 1 × 109 células/mL.
Para evaluar el crecimiento bacteriano planctónico y la formación de biopelícula de las cuatro especies bacterianas, después de exponerlas individualmente a diferentes concentraciones de NPs-SSBi, se llevaron a cabo los ensayos de turbidez y de XTT, respectivamente (Figura 3).
Figura 3
Representación de los ensayos realizados para evaluar el efecto antibacteriano de las NPs-SSBi, ensayos de turbidez y XTT.
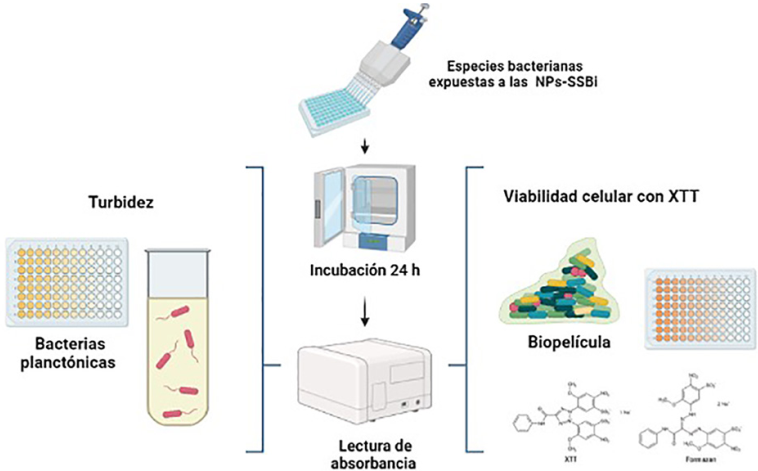
Fuente: Elaboración de los autores (con Biorender.com).
Para el ensayo de turbidez, se sembraron 20 µL de (1 × 109 células/mL) de cada especie bacteriana en placas de 96 pozos y se expusieron a diferentes concentraciones de NPs-SSBi (90, 80, 40, 20, 10, 5 y 2.5 µg/mL), con medio de cultivo TSB y se incubaron por 24 h a 35 ºC. Cada cepa bacteriana fue cultivada con TSB y clorhexidina al 0.2% para ser usado como control positivo, mientras que como control negativo las cepas se cultivaron en TSB sin NPs-SSBi. Posterior al tiempo de incubación, se midió la absorbancia de alícuotas de 100 μL de cada una de las muestras, a una longitud de onda de λ = 595 nm con un multilector de placas FilterMaxF5 (Dalgaard et al., 1994; Li et al., 1993; Mira et al., 2022).
El porcentaje del crecimiento bacteriano planctónico se calculó usando la siguiente ecuación:
Donde O.D. muestras tratadas corresponde a la absorbancia de bacterias en medio TSB expuestas a las diferentes concentraciones de NPs-SSBi, y O.D. muestra control corresponde a la absorbancia de las bacterias cultivadas en medio TSB sin NPs.
Para el segundo ensayo, se utilizó el kit colorimétrico de XTT (2,3-bis-(2-metoxi-4-nitro-5-sulfofenil)-2H-tetrazolio-5-carboxanilida) de invitrogenTM utilizado en diversos estudios (Braissant et al., 2020; Roehm et al., 1991), siguiendo el protocolo que indica el fabricante. Se realizó la misma metodología que en el ensayo de turbidez; solo que en este caso, posterior a las 24 h de incubación se adicionaron 20 µL de XTT a cada uno de los pozos que contenían las muestras y se dejaron incubar durante 3 h a 35 ºC. Posteriormente, se tomaron alícuotas de 100 µL de cada muestra, se diluyeron con 50 µL de PBS 1X y se midió la absorbancia a λ = 450 nm.
El porcentaje de viabilidad celular bacteriana se calculó usando la ecuación 1, pero en este caso, O.D. muestras tratadas corresponde a la absorbancia del XTT reducido por las bacterias viables expuestas a las diferentes concentraciones de NPs-SSBi y O.D. de las muestras controles, siendo el negativo la absorbancia del XTT reducido por las bacterias viables cultivadas en medio de cultivo sin NPs y el control positivo medio de cultivo con clorhexidina 0.2%. Ambos ensayos se realizaron por triplicado (n = 3) con cada una de las especies bacterianas y se ilustran también en la Figura 3.
Resultados experimentales y discusión
Caracterización de las NPs-SSBi mediante la espectroscopía UV-VIS
En la Figura 4A se presentan los espectros UV-Vis de las muestras de NPs-SSBi y SSBi en bulto medidos a la misma concentración (100 µg/mL), en ellos se observan dos bandas de absorción, una en 234-237 nm y otra de 296-303 nm, correspondientes a grupos funcionales del ácido salicílico presentes en la estructura molecular del SSBi, asimismo, la banda en 296 nm es considerada como la más estable y es característica del SSBi (Purvis, 1926), lo cual muestra que las NPs tienen la misma pureza y composición que el blanco utilizado en el proceso de ablación.
Figura 4
Espectros de UV-Vis. A). Comparación del espectro SSBi en bulto y de las NPs-SSBi. B). Se aprecia la estabilidad de los coloides a los días 1, 7, 21.
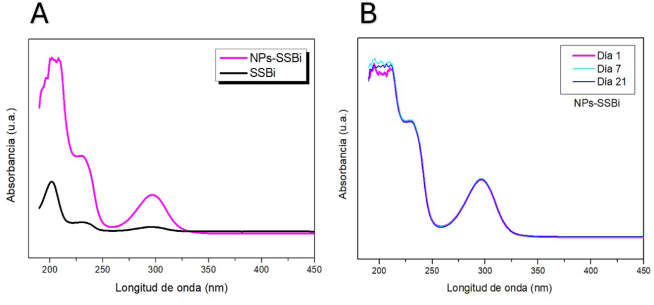
Fuente: Elaboración de los autores.
En la Figura 4BB se muestran los espectros de absorción de la suspensión coloidal de NPs-SSBi, medida a diferentes tiempos 1, 7 y 21 días de haberse producido. Se aprecia que en todas las mediciones el espectro de absorción se mantiene similar al del día 1, por lo cual la estabilidad de las NPs en suspensión coloidal se mantiene, por al menos 21 días posteriores a su obtención, posiblemente por su tamaño nanométrico, el cual les permite mantenerse dispersas entre las moléculas de agua por movimiento browniano.
A partir de las micrografías obtenidas por TEM (Figura 5A y 5B), se calculó que el tamaño promedio de las NPs-SSBi fue de 4.5 ± 0.18 nm, como se muestra en el histograma de frecuencias (Figura 5C), permitiéndoles mantenerse en suspensión coloidal (sin sedimentarse por gravedad) durante un periodo de tiempo prolongado. A partir de estas mediciones se determinó que las NPs-SSBi tienen un factor de forma de 0.75 ± 0.15, indicando poseer una morfología cuasi-esférica. Asimismo, por medio HRTEM (Figuras 5D y 5E), se observó que las NPs-SSBi tienen una estructura cristalina, cuyos patrones de difracción corresponden a las reflexiones (304) y (-222) con distancias interplanares de 3.25 y 2.94 Å, del SSBi en bulto reportado en las Tarjetas Powder Diffraction File™ (7001563 y 7001555) y al patrón de difracción de SSBi simulado en estudios previos (Reyes-Carmona et al., 2023; Vega-Jiménez et al., 2017).
Figura 5
A) y B). Micrografías TEM de las NPs-SSBi en donde se puede apreciar la morfología cuasiesférica. C). Histograma mostrando la distribución del tamaño promedio de las NPs. D) y E). Micrografías HRTEM, mostrando el patrón de difracción correspondiente a las reflexiones (304) y (-222) del SSBi.

Fuente: Elaboración de los autores.
Evaluación del efecto antibacteriano de las NPs-SSBi
Los resultados del ensayo de turbidez para determinar el crecimiento bacteriano en estado planctónico se aprecian en la Figura 6. Se observó que las NPs-SSBi redujeron el crecimiento de las cuatro cepas bacterianas de una manera dependiente de la concentración. En las cuatro especies evaluadas se observó una inhibición significativa del crecimiento planctónico al ser expuestas a concentraciones por arriba de 40 µg/mL de NPs-SSBi, siendo la concentración más alta de NPs-SSBi (90 µg/mL) la cual mostró un efecto inhibitorio mayor, de entre el 80-90%, en todas las cepas bacterianas probadas. Con E. coli se inhibió el 79.22%, con P. aeruginosa el 90.33 %, con S. aureus el 81.98% y con S. epidermidis 92.48 %. En el caso de las especies E. coli y S. aureus se identificó una reducción del crecimiento bacteriano significativo a partir de la concentración 20 µg/mL y 5 µg/mL de NPs-SSBi, respectivamente. En las menores concentraciones (2.5 y 1.25 µg/mL) no se observó reducción de la viabilidad bacteriana representativa.
Figura 6
Porcentaje de crecimiento bacteriano en estado planctónico de las cuatro bacterias nosocomiales expuestas a diferentes concentraciones de NPs-SSBi, *, P < 0.05 vs Ctrl- (bacterias cultivadas en TSB). Ctrl + (bacterias cultivadas en TSB y clorhexidina 0.2%).
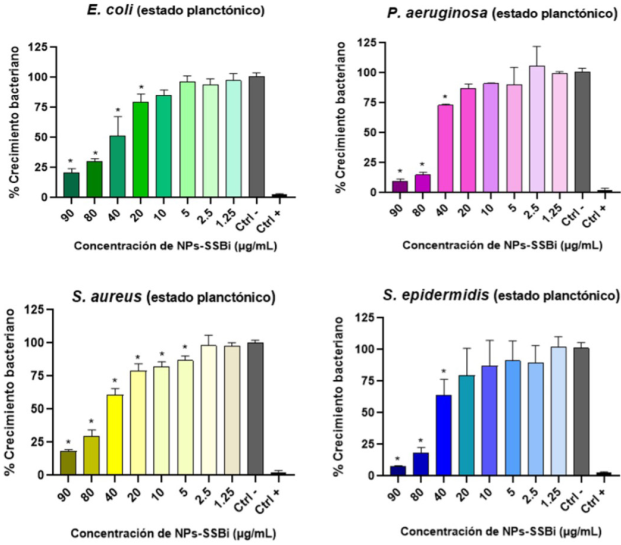
Fuente: Elaboración de los autores.
Con respecto al porcentaje de viabilidad de las bacterias adheridas a la superficie del pozo de cultivo (es decir, bacterias formando biopelícula) tras la interacción con diferentes concentraciones NPs-SSBi, se observó que solo las concentraciones más altas (80 y 90 µg/mL) lograron una reducción significativa de la viabilidad bacteriana (Figura 7). Específicamente a estas concentraciones se calculó una inhibición de la viabilidad bacteriana en E. coli del 75 y 84%, en P. aeruginosa del 80 y 89%, en S. aureus del 73 y 79%, y en S. epidermidis del 78 y 88%.
Figura 7
Porcentaje de viabilidad celular bacteriana en biopelícula de las cuatro bacterias nosocomiales evaluadas a diferentes concentraciones de NPs-SSBi, *, P < 0.05 vs Ctrl- (bacterias cultivadas en TSB). Ctrl + (bacterias cultivadas en TSB y clorhexidina 0.2%).
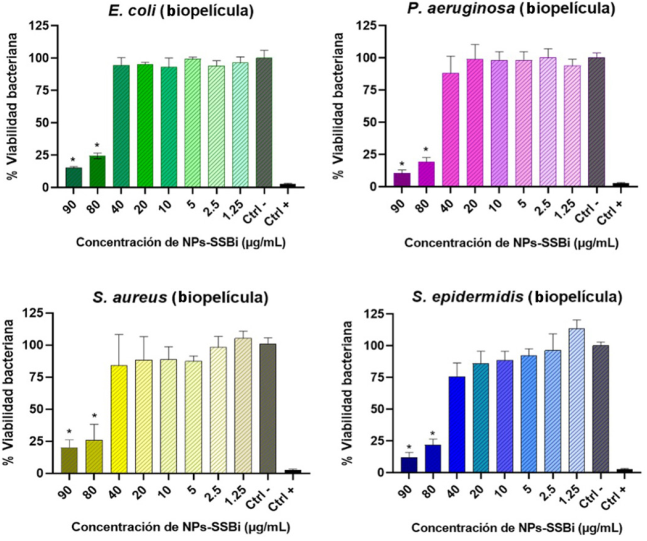
Fuente: Elaboración de los autores.
La significativa reducción de la viabilidad bacteriana a estas concentraciones de NPs-SSBi es de gran relevancia para el tratamiento de infecciones persistentes causadas por biopelículas bacterianas. Cabe mencionar que el hecho de ser menos sensibles las biopelículas a las NPs-SSBi que las bacterias en estado planctónico coincide con lo reportado en otras investigaciones de NPs inorgánicas antibacterianas. Por ejemplo, se ha reportado que la concentración requerida de NPs de Bi dimercaptopropanol (BisBAL) para inhibir cepas planctónicas de Streptococcus mutans y Streptococcus gordonii es de 5 µM, mientras que para inhibir su crecimiento en biopelícula se requeriría de una concentración de 100 µM (Badireddy et al., 2014). De manera similar, las NPs de Ag contra E. coli y P. aeruginosa aisladas de biopelículas fueron más resistentes que en su estado planctónico (Radzig et al., 2013).
Si bien el mecanismo de acción del SSBi no se comprende en su totalidad, en otras investigaciones han descrito que este compuesto es mayormente efectivo contra especies Gram negativas como E. coli o Helicobacter pylori (H. pylori), al ser capaz de reducir la producción de polisacáridos capsulares (Domenico et al., 1991), interferir con la síntesis de moléculas como adenosina trifosfato (ATP), lo cual es esencial para el almacenamiento y liberación de la energía celular bacteriana. Así como afectar la integridad de la membrana bacteriana (Sox y Olson, 1989). Por otro lado, el hecho de tener las NPs-SSBi tamaños de alrededor de 4.5 nm, favorece que las NPs puedan ingresar a la membrana celular bacteriana y ocasionar daño en la integridad de ácidos nucleicos (Hajipour et al., 2012) como se ilustra en la Figura 8. Por lo tanto, la capacidad antibacteriana de las NPs-SSBi contra las bacterias nosocomiales en estado planctónico y biopelícula podría asociarse con la afección del metabolismo bacteriano interfiriendo con la síntesis de moléculas como ATP, enzimas como la ureasa o catalasa, ocasionando daño y pérdida de la integridad de la membrana bacteriana y ácidos nucleicos.
Figura 8
Posible mecanismo de acción de las NPs-SSBi contra bacterias Gram negativas como E. coli.
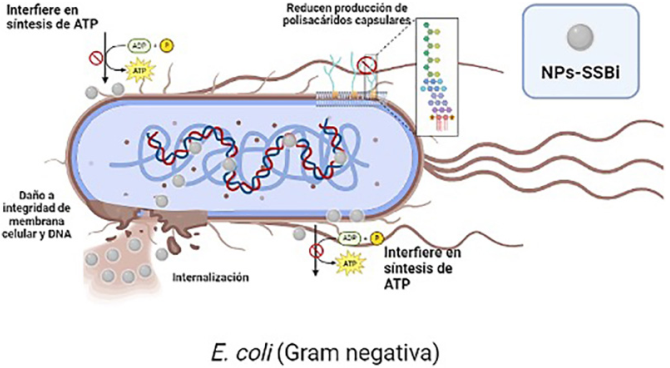
Fuente: Elaboración de los autores (con Biorender.com).
A pesar de que la formación de biopelícula se redujo únicamente cuando las bacterias fueron expuestas a las dos concentraciones más altas, 80 y 90 µg/mL, estas se encuentran muy por debajo de las dosis farmacéuticas aceptadas de SSBi en adultos (262-2100 mg por día), por lo cual es un fármaco eficaz y de baja toxicidad. Sin embargo, se ha reportado como posible manifestación de algunas de las reacciones adversas de este compuesto el oscurecimiento temporal en lengua y de heces fecales, debido a su mecanismo de acción antibacteriano (Dodge y Wackett, 2005).
El SSBi es soluble en ambientes ácidos, por lo cual, posiblemente al entrar en contacto con el microambiente ácido producido por las bacterias, este se puede disociar en iones Bi y salicilato, pudiendo ser capaces de interaccionar electrostáticamente con la envoltura celular y de reaccionar con mayor facilidad con otras moléculas por medio de reacciones redox.
Conclusiones
Se obtuvieron nanopartículas de subsalicilato de bismuto (NPs-SSBi) en suspensión coloidal, por medio de la técnica top-down de ablación láser de sólidos en líquidos (ALSL). Las NPs-SSBi presentaron una estructura cristalina, morfología cuasiesférica con un factor de forma de 0.75 y un tamaño promedio de 4.5 nm. En cuanto a la capacidad antibacteriana de las NPs-SSBi, el crecimiento de las cuatro bacterias nosocomiales fue inversamente proporcional a la concentración de NPs-SSBi. Se identificó la reducción del crecimiento bacteriano planctónico de manera significativa a partir de una concentración de 40 µg/mL. Mientras que la reducción de la viabilidad bacteriana en biopelícula fue significativa al exponerlas a las dos concentraciones más altas de NPs, 80 y 90 µg/mL.
Los resultados de este estudio indican que las NPs-SSBi tienen potencial para ser utilizadas como un agente antimicrobiano para reducir y controlar infecciones nosocomiales.
Referencias
Alharbi, S. A., Mashat, B. H., Al-Harbi, N. A., Wainwright, M., Aloufi, A. S. y Alnaimat, S. (2012). Bismuth-inhibitory effects on bacteria and stimulation of fungal growth in vitro. Saudi Journal of Biological Sciences, 19(2): 147-150. https://doi.org/10.1016/j.sjbs.2012.01.006.
S. A. Alharbi B. H. Mashat N. A. Al-Harbi M. Wainwright A. S. Aloufi S. Alnaimat 2012Bismuth-inhibitory effects on bacteria and stimulation of fungal growth in vitroSaudi Journal of Biological Sciences19214715010.1016/j.sjbs.2012.01.006
Allegranzi, B., Nejad, S. B., Combescure, C., Graafmans, W., Attar, H., Donaldson, L. y Pittet, D. (2011). Burden of endemic health-care-associated infection in developing countries: systematic review and meta-analysis. The Lancet, 377(9761): 228-241. https://doi.org/10.1016/S0140-6736(10)61458-4.
B. Allegranzi S. B. Nejad C. Combescure W. Graafmans H. Attar L. Donaldson D. Pittet 2011Burden of endemic health-care-associated infection in developing countries: systematic review and meta-analysisThe Lancet377976122824110.1016/S0140-6736(10)61458-4
Arena, J. (1974). Poisoning. Toxicology, symptoms, treatments. (American lecture series, 1019: American lectures in living chemistry). EUA: Universidad de Míchigan.
J. Arena 1974Poisoning. Toxicology, symptoms, treatmentsAmerican lecture series1019American lectures in living chemistryEUAUniversidad de Míchigan
Badireddy, A. R., Hernández-Delgadillo, R., Sánchez-Nájera, R. I., Chellam, S. y Cabral-Romero, C. (2014). Synthesis and characterization of lipophilic bismuth dimercaptopropanol nanoparticles and their effects on oral microorganisms growth and biofilm formation. Journal of Nanoparticle Research, 16(6): 2456. https://doi.org/10.1007/s11051-014-2456-5.
A. R. Badireddy R. Hernández-Delgadillo R. I. Sánchez-Nájera S. Chellam C. Cabral-Romero 2014Synthesis and characterization of lipophilic bismuth dimercaptopropanol nanoparticles and their effects on oral microorganisms growth and biofilm formationJournal of Nanoparticle Research166245610.1007/s11051-014-2456-5
Bagchi, D., McGinn, T. R., Ye, X., Balmoori, J., Bagchi, M., Stohs, S. J., Kuszynski, C. A., Carryl, O. R. y Mitra, S. (1999). Mechanism of gastroprotection by bismuth subsalicylate against chemically induced oxidative stress in cultured human gastric mucosal cells. Dig Dis Sci, 44(12): 2419-2428. https://doi.org/10.1023/a:1026618 501729.
D. Bagchi T. R. McGinn X. Ye J. Balmoori M. Bagchi S. J. Stohs C. A. Kuszynski O. R. Carryl S. Mitra 1999Mechanism of gastroprotection by bismuth subsalicylate against chemically induced oxidative stress in cultured human gastric mucosal cellsDig Dis Sci44122419242810.1023/a:1026618 501729
Braissant, O., Astasov-Frauenhoffer, M., Waltimo, T. y Bonkat, G. (2020). A review of methods to determine viability, vitality, and metabolic rates in microbiology. Frontiers in Microbiology, 11: 547458.
O. Braissant M. Astasov-Frauenhoffer T. Waltimo G. Bonkat 2020A review of methods to determine viability, vitality, and metabolic rates in microbiologyFrontiers in Microbiology11547458
Cornick, N. A., Silva, M. y Gorbach, S. L. (1990). In vitro antibacterial activity of bismuth subsalicylate. Rev Infect Dis, 12(Supl. 1): S9-10. https://doi.org/10.1093/clinids/12.supplement_1.s9.
N. A. Cornick M. Silva S. L. Gorbach 1990In vitro antibacterial activity of bismuth subsalicylateRev Infect Dis121S91010.1093/clinids/12.supplement_1.s9
Costerton, J. W., Stewart, P. S. y Greenberg, E. P. (1999). Bacterial biofilms: a common cause of persistent infections. Science, 284(5418): 1318-1322. https://doi.org/10.1126/science.284.5418.1318.
J. W. Costerton P. S. Stewart E. P. Greenberg 1999Bacterial biofilms: a common cause of persistent infectionsScience28454181318132210.1126/science.284.5418.1318
Dalgaard, P., Ross, T., Kamperman, L., Neumeyer, K. y McMeekin, T. A. (1994). Estimation of bacterial growth rates from turbidimetric and viable count data. International Journal of Food Microbiology, 23(3): 391-404. https://doi.org/10.1016/0168-1605(94)90165-1.
P. Dalgaard T. Ross L. Kamperman K. Neumeyer T. A. McMeekin 1994Estimation of bacterial growth rates from turbidimetric and viable count dataInternational Journal of Food Microbiology23339140410.1016/0168-1605(94)90165-1
Dodge, A. G. y Wackett, L. P. (2005). Metabolism of bismuth subsalicylate and intracellular accumulation of bismuth by Fusarium sp. strain BI. Appl Environ Microbiol, 71(2): 876-882. https://doi.org/10.1128/AEM.71.2.876-882.2005.
A. G. Dodge L. P. Wackett 2005Metabolism of bismuth subsalicylate and intracellular accumulation of bismuth by Fusarium sp. strain BIAppl Environ Microbiol71287688210.1128/AEM.71.2.876-882.2005
Domenico, P., Landolphi, D. R. y Cunha, B. A. (1991). Reduction of capsular polysaccharide and potentiation of aminoglycoside inhibition in Gram-negative bacteria by bismuth subsalicylate. J Antimicrob Chemother, 28(6): 801-810. https://doi.org/10.1093/jac/28.6.801.
P. Domenico D. R. Landolphi B. A. Cunha 1991Reduction of capsular polysaccharide and potentiation of aminoglycoside inhibition in Gram-negative bacteria by bismuth subsalicylateJ Antimicrob Chemother28680181010.1093/jac/28.6.801
Flemming, H.-C. y Wingender, J. (2010). The biofilm matrix. Nature Reviews Microbiology, 8(9): 623-633. https://doi.org/10.1038/nrmicro2415.
H.-C. Flemming J. Wingender 2010The biofilm matrixNature Reviews Microbiology8962363310.1038/nrmicro2415
Flores-Castañeda, M., González, E. C., Ruiz-Aguilar, I., Camps, E., Cruces, M. P., Pimentel, E. y Camacho-López, M. (2019). Preparation and characterization of organic nanoparticles by laser ablation in liquids technique and their biological activity. Materials Research Express, 6(10): 105091. https://doi.org/10.1088/2053-1591/ab3cf1.
M. Flores-Castañeda E. C. González I. Ruiz-Aguilar E. Camps M. P. Cruces E. Pimentel M. Camacho-López 2019Preparation and characterization of organic nanoparticles by laser ablation in liquids technique and their biological activityMaterials Research Express61010509110.1088/2053-1591/ab3cf1
Gómez Muñoz, C., Valdés Castro, R., Rodríguez Sánchez, Y. y Figueroa Moreno, R. (2023). Disertación del Boletín Infecciones Asociadas con la Atención de la Salud, agosto 2022. Medicina Interna de México, 39(5). https://doi.org/10.24245/mim.v39i5.8403.
C. Gómez Muñoz R. Valdés Castro Y. Rodríguez Sánchez R. Figueroa Moreno 2023Disertación del Boletín Infecciones Asociadas con la Atención de la Salud, agosto 2022Medicina Interna de México39510.24245/mim.v39i5.8403
Gosselin, R. E., Hodge, H. C., Smith, R. P., Gleason, M. N. (1976). Clinical toxicology of commercial products. Acute poisoning. Baltimore, M.D.: Williams & Wilkins.
R. E. Gosselin H. C. Hodge R. P. Smith M. N. Gleason 1976Clinical toxicology of commercial products. Acute poisoningBaltimore, M.D.Williams & Wilkins
Habashi, F. (2013). Bismuth, physical and chemical properties. En R. H. Kretsinger, V. N. Uversky y E. A. Permyakov (eds.), Encyclopedia of metalloproteins. Nueva York: Springer, 283-284. https://doi.org/10.1007/978-1-4614-1533-6_413.
F. Habashi 2013Bismuth, physical and chemical properties R. H. Kretsinger V. N. Uversky E. A. Permyakov Encyclopedia of metalloproteinsNueva YorkSpringer28328410.1007/978-1-4614-1533-6_413
Hajipour, M. J., Fromm, K. M., Akbar Ashkarran, A., Jiménez de Aberasturi, D., Larramendi, I. R. d, Rojo, T., Serpooshan, V., Parak, W. J. y Mahmoudi, M. (2012). Antibacterial properties of nanoparticles. Trends in Biotechnology, 30(10): 499-511. https://doi.org/10.1016/j.tibtech.2012.06.004.
M. J. Hajipour K. M. Fromm A. Akbar Ashkarran D. Jiménez de Aberasturi I. R. d Larramendi T. Rojo V. Serpooshan W. J. Parak M. Mahmoudi 2012Antibacterial properties of nanoparticlesTrends in Biotechnology301049951110.1016/j.tibtech.2012.06.004
Ibrahimkutty, S., Wagener, P., Rolo, T. D. S., Karpov, D., Menzel, A., Baumbach, T., Barcikowski, S. y Plech, A. (2015). A hierarchical view on material formation during pulsed-laser synthesis of nanoparticles in liquid. Scientific Reports, 5(1): 16313. https://doi.org/10.1038/srep16313.
S. Ibrahimkutty P. Wagener T. D. S. Rolo D. Karpov A. Menzel T. Baumbach S. Barcikowski A. Plech 2015A hierarchical view on material formation during pulsed-laser synthesis of nanoparticles in liquidScientific Reports511631310.1038/srep16313
Kappstein, I. y Engels, I. (1987). Antibacterial activity of sucralfate and bismuth subsalicylate in simulated gastric fluid. Eur J Clin Microbiol, 6(2): 216-217. http://www.ncbi.nlm.nih.gov/pubmed/3595590.
I. Kappstein I. Engels 1987Antibacterial activity of sucralfate and bismuth subsalicylate in simulated gastric fluidEur J Clin Microbiol62216217http://www.ncbi.nlm.nih.gov/pubmed/3595590
Koulinska, I., Riester, K., Chalkias, S. y Edwards, M. R. (2018). Effect of bismuth subsalicylate on gastrointestinal tolerability in healthy volunteers receiving oral delayed-release dimethyl fumarate: PREVENT, a randomized, multicenter, double-blind, placebo-controlled study. Clin Ther, 40(12): 2021-2030 e2021. https://doi.org/10.1016/j.clinthera.2018.10.013.
I. Koulinska K. Riester S. Chalkias M. R. Edwards 2018Effect of bismuth subsalicylate on gastrointestinal tolerability in healthy volunteers receiving oral delayed-release dimethyl fumarate: PREVENT, a randomized, multicenter, double-blind, placebo-controlled studyClin Ther401220212030e202110.1016/j.clinthera.2018.10.013
Lambert, J. R. y Midolo, P. (1997). The actions of bismuth in the treatment of Helicobacter pylori infection. Aliment Pharmacol Ther, abril 11(Supl. 1): 27-33. https://doi.org/10.1046/j.1365-2036.11.s1.13.x.
J. R. Lambert P. Midolo 041997The actions of bismuth in the treatment of Helicobacter pylori infectionAliment Pharmacol Therabril111273310.1046/j.1365-2036.11.s1.13.x
Lewis, R. J. (2007). Hawley’s condensed chemical dictionary, 12a ed., vol. 129. American Chemical Society. https://doi.org/10.1021/ja0769144.
R. J. Lewis 2007Hawley’s condensed chemical dictionary12129American Chemical Society10.1021/ja0769144
Li, R. C., Nix, D. E. y Schentag, J. J. (1993). New turbidimetric assay for quantitation of viable bacterial densities. Antimicrobial Agents and Chemotherapy, 37(2): 371-374. https://doi.org/doi:10.1128/aac.37.2.371.
R. C. Li D. E. Nix J. J. Schentag 1993New turbidimetric assay for quantitation of viable bacterial densitiesAntimicrobial Agents and Chemotherapy37237137410.1128/aac.37.2.371
Mafune, F., Kohno, J., Takeda, Y., Kondow, T. y Sawabe, H. (2000). Formation and size control of silver nanoparticles by laser ablation in aqueous solution. J. Phys. Chem. B, 104(39): 9111-9117. https://doi.org/10.1021/jp001336y.
F. Mafune J. Kohno Y. Takeda T. Kondow H. Sawabe 2000Formation and size control of silver nanoparticles by laser ablation in aqueous solutionJ. Phys. Chem. B104399111911710.1021/jp001336y
Magill, S. S., Edwards, J. R., Bamberg, W., Beldavs, Z. G., Dumyati, G., Kainer, M. A.,... y Fridkin, S. K. (2014). Multistate point-prevalence survey of health care-associated infections. New England Journal of Medicine, 370(13): 1198-1208. https://doi.org/10.1056/NEJMoa1306801.
S. S. Magill J. R. Edwards W. Bamberg Z. G. Beldavs G. Dumyati M. A. Kainer S. K. Fridkin 2014Multistate point-prevalence survey of health care-associated infectionsNew England Journal of Medicine370131198120810.1056/NEJMoa1306801
Mira, P., Yeh, P. y Hall, B. G. (2022). Estimating microbial population data from optical density. PLOS ONE, 17(10): e0276040. https://doi.org/10.1371/journal.pone.0276040.
P. Mira P. Yeh B. G. Hall 2022Estimating microbial population data from optical densityPLOS ONE1710e027604010.1371/journal.pone.0276040
OMS. (2022). OMS publica el primer informe mundial sobre prevención y control de infecciones (PCI). https://www.who.int/es/news/item/06-05-2022-who-launches-first-ever-global-report-on-infection-prevention-and-control.
OMS 2022OMS publica el primer informe mundial sobre prevención y control de infecciones (PCI)https://www.who.int/es/news/item/06-05-2022-who-launches-first-ever-global-report-on-infection-prevention-and-control
Pitz, A. M., Park, G. W., Lee, D., Boissy, Y. L. y Vinje, J. (2015). Antimicrobial activity of bismuth subsalicylate on Clostridium difficile, Escherichia coli O157:H7, norovirus, and other common enteric pathogens. Gut Microbes, 6(2): 93-100. https://doi.org/10.1080/19490976.2015.1008336.
A. M. Pitz G. W. Park D. Lee Y. L. Boissy J. Vinje 2015Antimicrobial activity of bismuth subsalicylate on Clostridium difficile, Escherichia coli O157:H7, norovirus, and other common enteric pathogensGut Microbes629310010.1080/19490976.2015.1008336
Purvis, J. E. (1926). CV.-The absorption spectra of various derivatives of salicylic acid. Journal of the Chemical Society (Resumed), 129(0): 775-778. https://doi.org/10.1039/JR9262900775.
J. E. Purvis 1926CV.-The absorption spectra of various derivatives of salicylic acidJournal of the Chemical SocietyResumed129077577810.1039/JR9262900775
Radzig, M. A., Nadtochenko, V. A., Koksharova, O. A., Kiwi, J., Lipasova, V. A. y Khmel, I. A. (2013). Antibacterial effects of silver nanoparticles on Gram-negative bacteria: Influence on the growth and biofilms formation, mechanisms of action. Colloids and Surfaces B: Biointerfaces, 102: 300-306. https://doi.org/10.1016/j.colsurfb.2012.07.039.
M. A. Radzig V. A. Nadtochenko O. A. Koksharova J. Kiwi V. A. Lipasova I. A. Khmel 2013Antibacterial effects of silver nanoparticles on Gram-negative bacteria: Influence on the growth and biofilms formation, mechanisms of actionColloids and Surfaces B: Biointerfaces10230030610.1016/j.colsurfb.2012.07.039
Reyes-Carmona, L., Camps, E., Campos-González, E., Mercado-Celis, G., Cervantes-Garduño, A., Pérez-Ibarra, E. A., Álvarez-Chimal, R., Rodil, S. E. y Almaguer-Flores, A. (2023). Antimicrobial evaluation of bismuth subsalicylate nanoparticles synthesized by laser ablation against clinical oral microorganisms. Optics & Laser Technology, 158: 108930. https://doi.org/10.1016/j.optlastec.2022.108930.
L. Reyes-Carmona E. Camps E. Campos-González G. Mercado-Celis A. Cervantes-Garduño E. A. Pérez-Ibarra R. Álvarez-Chimal S. E. Rodil A. Almaguer-Flores 2023Antimicrobial evaluation of bismuth subsalicylate nanoparticles synthesized by laser ablation against clinical oral microorganismsOptics & Laser Technology15810893010.1016/j.optlastec.2022.108930
Roehm, N. W., Rodgers, G. H., Hatfield, S. M. y Glasebrook, A. L. (1991). An improved colorimetric assay for cell proliferation and viability utilizing the tetrazolium salt XTT. J Immunol Methods, 142(2): 257-265. https://doi.org/10.1016/0022-1759(91)90114-u.
N. W. Roehm G. H. Rodgers S. M. Hatfield A. L. Glasebrook 1991An improved colorimetric assay for cell proliferation and viability utilizing the tetrazolium salt XTTJ Immunol Methods142225726510.1016/0022-1759(91)90114-u
Semaltianos, N. G., Hendry, E., Chang, H., Wears, M. L., Monteil, G., Assoul, M., Malkhasyan, V., Blondeau-Patissier, V., Gauthier-Manuel, B. y Moutarlier, V. (2016). ns or fs pulsed laser ablation of a bulk InSb target in liquids for nanoparticles synthesis. J Colloid Interfaces, (469): 57-62. https://doi.org/10.1016/j.jcis.2016.01.069.
N. G. Semaltianos E. Hendry H. Chang M. L. Wears G. Monteil M. Assoul V. Malkhasyan V. Blondeau-Patissier B. Gauthier-Manuel V. Moutarlier 2016ns or fs pulsed laser ablation of a bulk InSb target in liquids for nanoparticles synthesisJ Colloid Interfaces469576210.1016/j.jcis.2016.01.069
Sox, T. E. y Olson, C. A. (1989). Binding and killing of bacteria by bismuth subsalicylate. Antimicrob Agents Chemother, 33(12): 2075-2082. https://doi.org/10.1128/aac.33.12.2075.
T. E. Sox C. A. Olson 1989Binding and killing of bacteria by bismuth subsalicylateAntimicrob Agents Chemother33122075208210.1128/aac.33.12.2075
USGS. (2021). Mineral commodity summaries 2021. Report. Mineral Commodity Summaries, Issue. U. S. G. Survey. https://pubs.usgs.gov/publication/mcs2021.
USGS 2021Mineral commodity summaries 2021Report. Mineral Commodity SummariesIssueU. S. G. Surveyhttps://pubs.usgs.gov/publication/mcs2021
Vega-Jiménez, A., Berea-Montes, E. y Almaguer-Flores, A. (2012). Susceptibility of E. coli, P. aeruginosa, S. aureus and S. epidermidis to different bismuth compounds. MRS Proceedings, 1487.
A. Vega-Jiménez E. Berea-Montes A. Almaguer-Flores 2012Susceptibility of E. coli, P. aeruginosa, S. aureus and S. epidermidis to different bismuth compoundsMRS Proceedings1487
Vega-Jiménez, A. L., Almaguer-Flores, A., Flores-Castañeda, M., Camps, E., Uribe-Ramírez, M., Aztatzi-Aguilar, O. G. y De Vizcaya-Ruiz, A. (2017). Bismuth subsali - cylate nanoparticles with anaerobic antibacterial activity for dental applications. Nanotechnology, 28(43): 435101. https://doi.org/10.1088/1361-6528/aa8838.
A. L. Vega-Jiménez A. Almaguer-Flores M. Flores-Castañeda E. Camps M. Uribe-Ramírez O. G. Aztatzi-Aguilar A. De Vizcaya-Ruiz 2017Bismuth subsali - cylate nanoparticles with anaerobic antibacterial activity for dental applicationsNanotechnology284343510110.1088/1361-6528/aa8838
Yakoob, J., Abbas, Z., Usman, M. W., Awan, S., Naz, S., Jafri, F., Hamid, S. y Jafri, W. (2014). Comparison of antimicrobial activity of zinc chloride and bismuth subsalicylate against clinical isolates of Helicobacter pylori. Microb Drug Resist, 20(4): 305-309. https://doi.org/10.1089/mdr.2013.0086.
J. Yakoob Z. Abbas M. W. Usman S. Awan S. Naz F. Jafri S. Hamid W. Jafri 2014Comparison of antimicrobial activity of zinc chloride and bismuth subsalicylate against clinical isolates of Helicobacter pyloriMicrob Drug Resist20430530910.1089/mdr.2013.0086
Yang, G. W. (ed.). (2012). Laser ablation in liquids. Principles and applications in the preparation of nanomaterials. Nueva York: Jenny Stanford Publishing, 1192 pp. https://doi.org/Book_Doi 10.1201/B11623.
G. W. Yang 2012Laser ablation in liquids. Principles and applications in the preparation of nanomaterialsNueva YorkJenny Stanford Publishing1192Book_Doi 10.1201/B11623