Introducción
El crecimiento acelerado de la población, los cambios productivos y el consumo masivo de recursos han generado grandes cantidades de desechos convirtiéndose en un pasivo ambiental importante. Las aguas residuales industriales representan una fuente de contaminación alterando la calidad del agua al ser dispuestas al medio ambiente sin los debidos tratamientos. La descarga de contaminantes es una grave amenaza para el medio ambiente y para todos los seres vivos habitando en él (Solomon y otros, 2013). Estos compuestos no solo contaminan cuerpos de agua, sino incrementan también el desarrollo de enfermedades por consumo de agua contaminada o acumulación en la cadena trófica. Entre los contaminantes inorgánicos más tóxicos se encuentran los metales pesados (MP), los cuales se caracterizan por ser compuestos persistentes y no biodegradables (García y otros, 2002). Se estima verter, en promedio, 109 kg al año de metales pesados a medios acuáticos como resultado de diversas actividades antropogénicas (Caviedes y otros, 2015). Debido a los efectos nocivos generados por estos contaminantes inorgánicos, la contaminación de agua por metales pesados constituye una de las principales preocupaciones a nivel ambiental (Benítez y otros, 2020); por consiguiente, es necesario contar con métodos de tratamiento de aguas simples, económicos y eficientes para lograr recuperar la calidad del agua por efectos de la contaminación.
El proceso de adsorción se ha adoptado como el método por excelencia para el tratamiento de aguas con metales pesados, debido a ofrecer diversas ventajas a nivel ambiental, pues existen muchos materiales sólidos con alta capacidad para concentrar estos elementos en su superficie, y permite la utilización de biomasa como material adsorbente de bajo costo. En este sentido, la selección e identificación de un adsorbente económico y con alta capacidad es fundamental para alcanzar la remoción de metales pesados en soluciones acuosas (Brown, Grill y Allen, 2000). En los últimos años se ha prestado especial atención a la aplicación de nanomateriales magnéticos como adsorbentes, por sus atractivas propiedades únicas, en especial aquellos formados por partículas de óxido de hierro (Matmin y otros, 2018). Estos adsorbentes ofrecen potenciales ventajas tales como alta capacidad de adsorción, actividad catalítica mejorada y alta relación superficie-volumen (Matmin y otros, 2018).
Chang y Chen (2005) encontraron que los bioadsorbentes magnéticos (BM) tienen mejores efectos purificadores, son fáciles de remover una vez terminado el proceso de tratamiento y, agotada su capacidad de remoción, no generan un impacto negativo en el medio ambiente. Jixiang y colaboradores (2017) han evaluado las aplicaciones de adsorbentes magnéticos en la remoción de cobre (II), los cuales presentaron alta capacidad de adsorción y posibilidad de reúso en cinco ciclos con tasas de remoción cercanas al 95%. En otro estudio, Cai, Zhang y Luo (2017) estudiaron la síntesis de nanopartículas de magnetita a partir de un conjugado de amonio para remover rojo Congo y cromo (VI) de soluciones acuosas, en donde se obtuvieron capacidades de adsorción de 389.1 y 118 , respectivamente. En este último trabajo, los autores reportaron que la aplicación de estos materiales puede ser económicamente viable y de fácil aplicación industrial. Por último, Portillo (2018) estudió la adsorción de algunos metales pesados empleando un bioadsorbente de pectina con nanopartículas magnéticas, obteniendo capacidades de adsorción de 36.442 , 8.927 y 2.254 , las cuales pueden ser mejoradas a través de la aplicación de campos magnéticos, promoviendo la interacción de las especies metálicas por efecto del aumento de la fuerza del campo magnético inducido. Además, un factor a considerar durante la síntesis de nanopartículas magnéticas es su inestabilidad química en el tiempo, en donde suelen formar aglomerados y ser susceptibles a oxidarse fácilmente en el aire (Lu, Salabas y Schuth, 2007). Durante la síntesis de estos materiales es crucial emplear un material alternativo para estabilizar químicamente las nanopartículas magnéticas. Por lo general, se les suele impregnar o recubrir en un material orgánico (Lu, Salabas y Schuth, 2007); en el caso de la presente investigación se empleó la pectina, proveniente del Aloe Barbadensis Miller (sábila), como material base.
Con base en los trabajos mencionados, se planteó aplicar las propiedades magnéticas de un bioadsorbente de hierro para la remoción de plomo (II) y cromo (VI) en soluciones acuosas. Para ello, se estimó la capacidad de remoción para estos metales pesados a través de la elaboración de isotermas de adsorción. Se construyeron las curvas de ruptura para el plomo (II) con la finalidad de estimar la capacidad de remoción en un adsorbedor empacado con lecho fresco y reutilizado en presencia de un campo magnético externo. Finalmente, las propiedades magnéticas del adsorbente permitieron modificar los arreglos tradicionales de adsorción para proponer nuevos esquemas de operación y comparar su eficiencia en términos de capacidad de remoción y dimensiones de los equipos empleados.
Materiales y metodología
Los reactivos químicos empleados en este trabajo incluyen: C3H8O (isopropanol) en solución acuosa al 70% (Ecocleam), C2H6O (etanol) en solución acuosa al 70% (Laboratorios Vargas), C4H10O (n-butanol) en solución acuosa al 99% (Fisher Scientific Company), HCl (ácido clorhídrico) en solución acuosa al 37% m/v (Merck), FeCl33 • 6H2O (cloruro férrico hexahidratado) con 99% de pureza (Riedel de Haën), FeSO4• 7H2O (sulfato ferroso heptahidratado) con 99% de pureza (Sigma Aldrich), N2 (nitrógeno gaseoso) inerte (AGA laboratory), NH4OH (hidróxido de amonio) en solución al 25% (BDH laboratory reagents), K2Cr2O7 (dicromato de potasio) con grado analítico 99.95% de pureza (Merck) y Pb(NO3)2 (nitrato de plomo) con grado analítico 99% de pureza (Riedel de Haën).
Síntesis del bioadsorbente magnético
El bioadsorbente sintetizado en este trabajo está compuesto por pectina como base inerte (proveniente de las hojas del Aloe Barbadensis Miller) y magnetita (la cual aporta las cualidades magnéticas al material). Las hojas fueron previamente preparadas para extraer la pectina de su estructura. Para ello, se cortaron cuatro pencas de sábila, se lavaron con abundante agua y se removió el látex de cada una de ellas conservando únicamente la hoja de la planta. Se realizaron cortes de aproximadamente 0.5 cm x 0.5 cm, los cuales fueron sumergidos en la solución del n-butanol, a una temperatura de 85 ºC por 72 min con agitación 600 rpm. Posteriormente, se filtró la biomasa y se le sometió a una reacción de desesterificación ácida con 250 mL de solución HCl 1.5 M por 18 horas en agitación a 380 rpm, con el fin de aumentar el número de sitios disponibles para el intercambio del grupo hierro-carbonilo en COO-Fe. El material resultante fue lavado con las soluciones de etanol e isopropanol hasta alcanzar un pH = 3.5; luego, se le filtró y dejó secar en estufa a 75 ºC por 18 horas.
Para la obtención de la magnetita, se estimó la cantidad de hierro necesaria en la síntesis a partir de las relaciones de 10 y 0.35 reportadas en la literatura (Portillo, 2018). Se preparó una solución de sales de hierro a partir de las sales de FeCl3• 6H2O y FeSO4• 7H2O con una proporción estequiométrica 2:1 para ambos cationes de hierro. La síntesis del bioadsorbente se llevó a cabo mediante el método de coprecipitación en presencia de nitrógeno gaseoso. Se emplearon 25 mL de solución de NH4OH para lograr la precipitación de la magnetita. El sólido se lavó con agua destilada hasta alcanzar un pH neutro, se filtró y se secó a 75 ºC en la estufa durante 24 horas.
Caracterización por espectroscopía infrarroja por transformada de Fourier (FTIR)
Se evaluaron tres muestras: biomasa original, biomasa desesterificada y bioadsorbente sintetizado. El análisis se realizó con un espectrómetro (ThermoFisher Nicolet iS5) con módulo ATR i5. El registro de los espectros infrarrojos se realizó mediante escáner de 64 barridos con resolución 4, entre 600 a 4000 cm-1.
Caracterización por difracción de rayos X (DRX)
Esta técnica se utilizó para identificar la fase cristalina predominante en el bioadsorbente sintetizado. Se realizó el análisis en un difractómetro (Bruker D2 Phaser) con λ = 1.54184 Å. Se empleó radiación a 30 kV, 10 mA y 300 W con rotación 15 tours/min. El difractograma se tomó desde 10º hasta 60º en 2θ a un paso de 0.02 º/s, los datos obtenidos fueron analizados y comparados con la base de datos del software libre de análisis de difracción Match! (versión 3.15).
Caracterización por microscopía electrónica de barrido (MEB)
Se realizó el análisis por MEB de la pectina base, el bioadsorbente antes y después de la adsorción. Se empleó un microscopio electrónico de barrido (JEOL modelo JSM-6390). Las muestras fueron secadas y recubiertas con grafito y oro mediante la técnica sputtering. Las micrografías obtenidas fueron tomadas en un rango de 10-500 𝜇m con aumentos desde 30x-15.000x para, de esta manera, estimar el tamaño promedio de partícula. El análisis acoplado con electrones retrodispersados (EDX) permitió identificar y estimar las proporciones atómicas de los principales elementos químicos que formaban parte de la estructura del sólido, así como comprobar la presencia de los metales adsorbidos en la superficie de este.
Isotermas de adsorción
Se prepararon soluciones de iones de plomo (II) y cromo (VI) con concentraciones de 1000 ppm y 500 ppm, respectivamente. Las sales empleadas fueron el K2Cr2O7 y el Pb(NO3)2. Para cada ion metálico, se prepararon cinco diluciones para obtener las soluciones patrón requeridas en la construcción de las isotermas (Plomo: 100, 120, 200, 250 y 400 ppm; y cromo: 12.5, 25, 30, 50 y 100 ppm). Las isotermas de adsorción de los metales pesados se realizaron siguiendo una relación 10:1 de volumen de solución y dosis de adsorbente (previamente secado). Se colocó una cantidad fija del material y se le dejó en contacto con cada solución patrón de concentración conocida, en agitación a 180 rpm a temperatura de (25 ± 1) ºC en baño térmico estatizado durante 22 horas para asegurar que se alcance la condición de equilibrio. El pH empleado fue constante y equivalente a 6-7. Una vez transcurrido el tiempo de equilibrio, se dejaron sedimentar las partículas sólidas y se tomó una alícuota del sobrenadante para análisis posterior por absorción atómica. Las concentraciones en el equilibrio se obtuvieron a través de un espectrofotómetro de absorción atómica (modelo Savant AA, marca GBC). Se utilizó llama de aire-acetileno en mechero plano, para cada metal se empleó la lámpara de cátodo hueco correspondiente para el análisis espectrofotométrico. Los datos experimentales obtenidos fueron ajustados a los modelos de Langmuir y Freundlich (ecuaciones 1 y 2) mediante el uso de un software de análisis de datos.
Estas curvas permitieron interpretar el comportamiento de la interacción bioadsorbente-iones de metales pesados en condiciones de equilibrio, así como también estimar la capacidad máxima de remoción del bioadsorbente sintetizado bajo condiciones estáticas sin uso de campo magnético.
Evaluación del bioadsorbente en diferentes arreglos
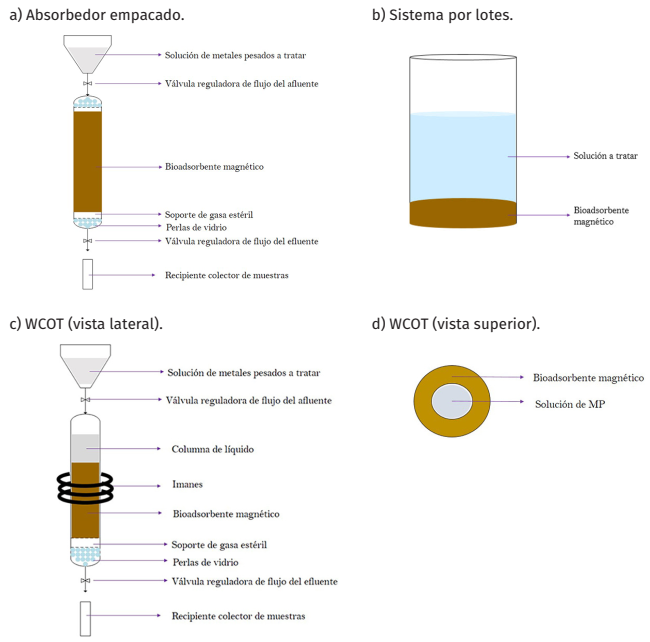
Primero, se evaluó la operación de una columna de adsorción de lecho empacado (CALE), también denominada adsorbedor empacado. Para ello, se empleó una columna de vidrio con diámetro interno de 12 cm y altura de 16.5 cm; en el fondo y en el tope se colocó un soporte de gasa para garantizar una distribución homogénea de la solución y evitar la pérdida del material durante la operación. Asimismo, se introdujo un volumen de bioadsorbente de 13.6 mL para tratar una solución de 100 ppm Pb(NO3)2. En la Tabla 1 se muestran las condiciones de operación fijadas para este montaje experimental.
Tabla 1
Parámetros de operación utilizados en la CALE.
| Variable de operación | Valor |
|---|---|
| 100 | |
| 2.2 | |
| 2.7 | |
| V solución a tratar | 300 |
[i] Fuente: Vera y otros (2018).
Se introdujo la solución de metales pesados a la CALE y se dejó caer por acción de la gravedad (Figura 1a). Se tomaron alícuotas de efluente, durante 5 ½ horas, y se almacenaron para análisis posterior. Se determinaron por espectrofotometría de absorción atómica las concentraciones obtenidas para cada volumen de efluente tratado. Una vez obtenidos los datos experimentales, se realizó un ajuste de regresión no lineal a los modelos de Thomas y de dosis-respuesta (D-R), empleados para la construcción de curvas de ruptura (ecuaciones 3 y 4).
Con el propósito de evaluar el efecto del magnetismo en el proceso de adsorción dinámica, se realizó una prueba experimental donde se utilizó el mismo adsorbedor empacado (ya utilizado y previamente lavado con 70 ml de agua destilada) sometido a un campo magnético generado por un arreglo de imanes. El experimento se llevó a cabo bajo las mismas condiciones de operación, se tomaron alícuotas de efluente, durante 5 horas, y se almacenaron para su análisis posterior vía absorción atómica. Además, se evaluó un sistema por lotes (Figura 1b), en donde se utilizó una dosis fija de adsorbente para tratar soluciones con tiempo de contacto variable; también se estudió este arreglo con presencia de un campo magnético externo. Por último, se magnetizó un tubo de vidrio para simular la operación de una columna de pared recubierta en tubo abierto (Figuras 1c y 1d), conocida por sus siglas en inglés como wall-coated open tubular (WCOT). La solución por tratar se dejó en contacto con el bioadsorbente con un tiempo fijo, posterior a este tiempo se colectó la muestra tratada. En la Tabla 2 se resumen los diferentes arreglos evaluados en este trabajo.
Resultados y discusión
Caracterización del bioadsorbente magnético por FTIR
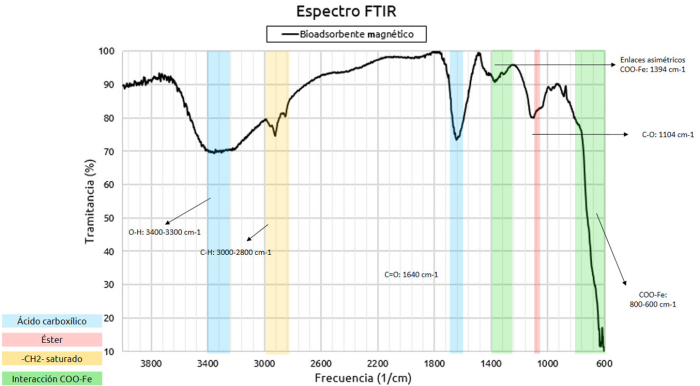
En la Figura 2 se presenta el espectro infrarrojo (IR) de la biomasa original. Se aprecian señales características del ácido carboxílico, las cuales corresponden a los grupos -COOH presentes en la estructura de la pectina; se nota una banda a 3322 cm-1, asociada con la tensión del enlace O-H (Foba-Tendo y otros, 2013). Se evidencian señales a 2917 y 2850 cm-1 asociadas con enlaces del tipo C-H, presentes en la estructura orgánica de este compuesto (Meza-Gaspar y otros, 2017). Se observan también señales propias del grupo éster a una frecuencia de 1730 y 1315 cm-1 correspondientes a la tensión de los enlaces C = O y C-O, respectivamente (Meza-Gaspar y otros, 2017). Estos grupos forman parte de las unidades monoméricas de la pectina, la cual se compone de un polímero natural cuyo principal polisacárido es el ácido galacturónico con enlaces metilo-éster en su estructura (García y otros, 2011). En el espectro infrarrojo de la muestra de la biomasa desesterificada (Figura 3) se observa que, para frecuencias por encima de los 2800 cm-1, no ocurren cambios significativos con respecto al espectro IR de la biomasa de partida. Los cambios más apreciables se observan en las señales características de los grupos ácido carboxílico y éster. Se evidencia una señal de alta intensidad a una frecuencia de 1600 cm-1 asociada con la vibración y tensión del enlace C = O del grupo ácido carboxílico (Meza-Gaspar y otros, 2017). La aparición de señales a 1400 cm-1 indica la formación de enlaces C-O-H dentro de la estructura (Guerra y Portillo, 2018), lo cual sugiere que el proceso de desesterificación aumentó la presencia del grupo -COOH en la biomasa. Asimismo, se estimó el grado de desesterificación a partir de la relación entre la intensidad de las bandas correspondientes con el enlace del carbonilo (C = O) para el éster y el ácido carboxílico en los espectros IR de ambas muestras, se obtuvo un grado de desesterificación del 62.8 %, demostrando que, si bien el tratamiento fue efectivo para remover parte de los grupos éster presentes en la biomasa, la desesterificación no fue completa, manteniendo la muestra cierto grado de esterificación.
Figura 2
Espectro FTIR y señales características para la muestra de biomasa de partida.
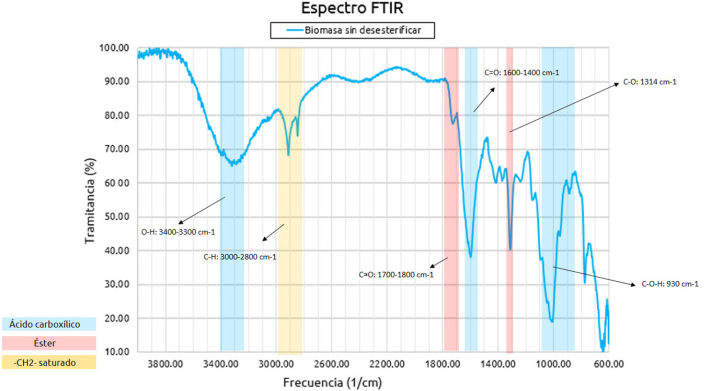
Fuente: Fuente: Elaboración de las autoras.
Figura 3
Espectro FTIR y señales características para la muestra de biomasa desesterificada.
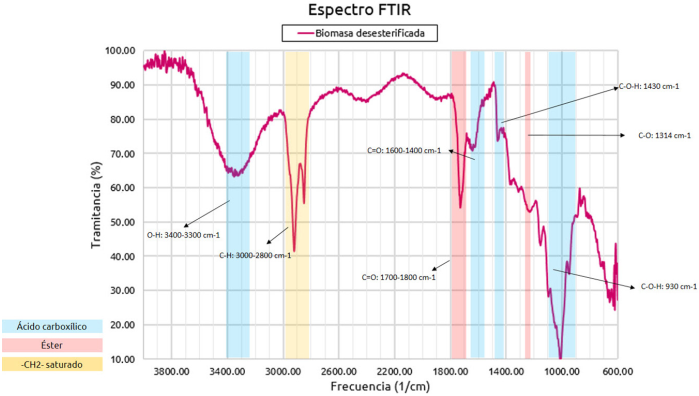
Fuente: Fuente: Elaboración de las autoras.
Al incorporar la magnetita a la biomasa desesterificada (Figura 4) se evidencian cambios en las señales de las bandas registradas para frecuencias de 1600-1300 cm-1 y una banda intensa en la región 800-600 cm-1, lo cual indica la presencia de enlaces del tipo hierro-carbonilos pertenecientes a la interacción -COO-Fe (Foba-Tendo y otros, 2013), esta interacción se establece entre el ion hierro con los grupos carboxílicos. Los iones de hierro se impregnan en los grupos carboxílicos que se encuentran en la pectina y permanecen en ella, incluso después de su precipitación (Guerra y Portillo, 2018).
Caracterización del bioadsorbente magnético a través de DRX
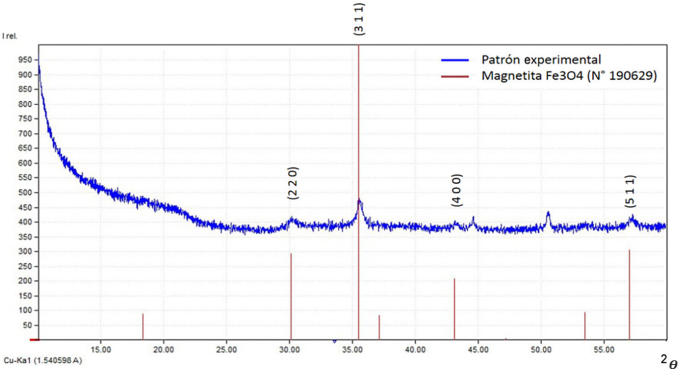
La magnetita sintética es susceptible a oxidarse en periodos de tiempo cortos y, en consecuencia, coexiste con otras fases cristalinas de hierro. La oxidación puede generarse como resultado del contacto entre el aire húmedo y la muestra (Toma, 2015) o por el pequeño alcance de formación de la red cristalina dentro de la pared vegetal de la biomasa (Guerra y Portillo, 2018). La línea espectral de la muestra analizada (Figura 5) fue comparada con el patrón de difracción número 190629 de la base de datos del Comité Conjunto de Difracción de Polvo Estándar (JCPDS), característico de la fase cristalográfica de la magnetita (De León y otros, 2019). La muestra analizada exhibe cuatro coincidencias con las señales de alta intensidad características de la magnetita (Foba-Tendo y otros, 2013) en las ubicaciones º2𝜭 = 30.1; 35.4; 43.3 y 57.0; en la Figura 5 se incluyen los planos cristalográficos correspondientes a estas ubicaciones. Son pocas las señales no coincidentes con esta línea patrón, lo cual comprueba la existencia de una fase limpia de magnetita en el bioadsorbente sintetizado, mayoritaria con respecto a otras fases cristalinas. Se observan también señales de baja intensidad, lo cual indica que las fases cristalinas formadas después de la síntesis de la magnetita son de orden nanométrico (Guerra y Portillo, 2018).
Caracterización del bioadsorbente magnético por MEB
En la Tabla 3 se muestran las microfotografías y el análisis químico obtenidos a través de la MEB-EDX. Las muestras analizadas corresponden a la biomasa pre-tratamiento de desesterificación (M1), biomasa post-tratamiento de desesterificación (M2) y al bioadsorbente magnético de magnetita-pectina (M3). Para M1 se aprecia la matriz vegetal de la piel del Aloe vera, de donde proviene la pectina, la cual está compuesta por elementos circulares. Además, se nota la presencia de largas agujas sobre la pared celular con zonas más oscuras correspondientes a la piel de la planta. Los principales elementos que formaron parte de esta muestra fueron el carbono y el oxígeno, presentes en la estructura química del ácido galacturónico en la pectina (García y otros, 2011). No obstante, se observa una pequeña proporción atómica de calcio, formando también parte de la piel del Aloe vera (Femenia y otros, 2017). Posterior al proceso de desesterificación (M2), se observa que, aunque el material conserva su matriz vegetal, los elementos circulares disminuyeron su profundidad y aumentaron su diámetro. Las largas agujas presentes en la muestra anterior desaparecieron y la superficie de la base vegetal exhibe un matiz más limpio. El oxígeno es el elemento que aporta la mayor proporción atómica pues el contenido de calcio es inexistente como resultado del tratamiento de desesterificación. Por último, en M3 se aprecian aglomerados de cristales con zonas brillantes fijados sobre la matriz vegetal del Aloe vera, los cuales corresponden a los cristales de magnetita tipo framboides (Foba-Tendo y otros, 2013). También, se observa una proporción significativa de hierro sobre el material como resultado de la incorporación de la magnetita en la biomasa. Es importante destacar que, la proporción atómica de oxígeno supera al hierro casi 13 veces porque en el análisis químico se toma en cuenta tanto el oxígeno que forma parte de la magnetita como el que se encuentra presente en el polisacárido base de la pectina; este último, al estar formado por varias unidades de ácido galacturónico posee un contenido alto de oxígeno (García y otros, 2011).
Tabla 3
Microfotografías obtenidas para las tres muestras de sólido fresco.
En las microfotografías también fue posible observar zonas más brillantes, correspondientes a los cristales de magnetita, adheridos a la pared celular e impregnados sobre el material base (Tabla 4).
Isotermas de adsorción
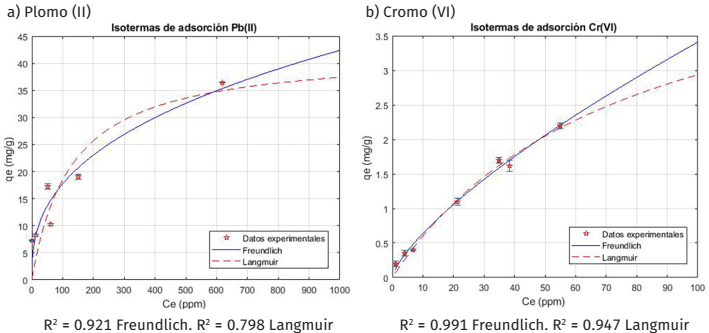
Se estudió el equilibrio de adsorción mediante la aplicación de los modelos predictivos de Langmuir y Freundlich (ecuaciones 1 y 2), los cuales relacionan la capacidad de adsorción de equilibrio con la concentración final alcanzada (Chen y otros, 2022). En la Figura 6 se muestran las isotermas de adsorción resultantes para el plomo (II) y el cromo (VI) junto con las funciones de ajuste a los modelos mencionados. En ambos casos, la isoterma presentó forma convexa con ausencia de Plateu y los datos experimentales se ajustaron en mayor medida al modelo de Freundlich, el cual describe apropiadamente la adsorción en un rango de concentración donde aún no se ha alcanzado el equilibrio y es apropiado para los casos en los cuales el adsorbente presenta superficie heterogénea, en donde se produce una multicapa de adsorbato sobre el material (Giraldo Erto y Moreno, 2013). En este sentido, las interacciones predominantes entre los metales pesados y el bioadsorbente son del tipo débiles (Giraldo Erto y Moreno, 2013). Dado que el modelo de Freundlich no permite predecir la capacidad máxima en términos de saturación del adsorbente (Chen y otros, 2022), se tomó la capacidad máxima del material como la capacidad más alta obtenida entre los puntos experimentales (Tabla 5).
Tabla 5
Capacidades de adsorción máximas registradas para los iones de MP.
| Metal Pesado | Capacidad máxima de adsorción |
|---|---|
| Plomo (II) | |
| Cromo (VI) |
La capacidad máxima de adsorción obtenida para el plomo (II) fue de 36.442 , este valor es próximo al obtenido por El-Dib y colaboradores (2020) en la evaluación de nanopartículas de magnetita pura como adsorbente con capacidad adsorbativa de 42.553 . Además, es mayor a las reportadas en la literatura para diversos materiales compuestos de hidrogel reforzados con residuos de aceite de palma y de la planta Pinus Halepensis cuyas capacidades de adsorción fueron de 30.031 y 8.64 , respectivamente (Bilal y otros 2021). En cuanto al cromo (VI), la capacidad máxima de adsorción fue de 2.254 ; este valor es mayor al reportado en trabajos previos. Rojas y Zarate (2015) estudiaron la adsorción de este metal pesado en soluciones acuosas con montmorillonita, obteniendo capacidades adsorbativas de hasta 0.052 . En otro estudio, Zhao y colaboradores (2021) estudiaron la adsorción de cromo (III) y (VI) utilizando hojas de pino como bioadsorbente con capacidad de adsorción de 0.454 .
Los iones de plomo (II) presentaron mayor afinidad hacia el adsorbente magnético, con una capacidad de adsorción casi 15 veces mayor a la obtenida para el cromo (VI), esto debido a que este ion, al tener mayor masa atómica, presenta menor movilidad en solución acuosa y a las propiedades magnéticas del adsorbente (Guerra y Portill, 2018). Además, los sitios activos del bioadsorbente poseen una densidad de carga negativa elevada, con alta capacidad para atraer cationes. El plomo (II) se encuentra en su forma catiónica, mientras que, el cromo (VI) se encuentra dentro del ion dicromato con carga negativa, razón por la cual, este último experimentó dificultades para adherirse en las zonas activas del bioadsorbente, comportamiento reflejado en las capacidades de adsorción obtenidas. Por las razones expuestas anteriormente, se comprueba que el material sintetizado es un excelente adsorbente para el plomo (II) y un buen adsorbente para el cromo (VI). De esta manera, los resultados aquí reportados, para la remoción de ambos iones de metales pesados son altamente satisfactorios para el material sintetizado, el cual exhibe capacidades comparativas a las reportadas por otros autores en sistemas similares. La incorporación de las partículas de magnetita sobre la pectina potencia las propiedades de adsorción del material de biomasa base y este puede resultar más beneficioso que otros sólidos de base inorgánica para la remoción de estos metales pesados, aportando una excelente solución a este tipo de contaminantes.
Evaluación del bioadsorbentes en diferentes arreglos
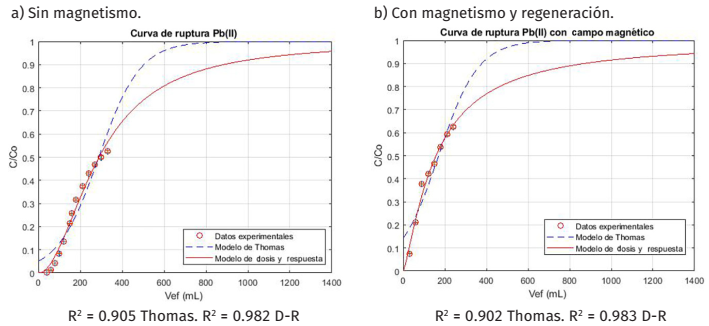
La adsorción en operación dinámica y continua se estudió a través de la aplicación de los modelos predictivos de Thomas y dosis-respuesta (ecuaciones 3 y 4), los cuales relacionan la fracción de metal pesado removido en función del volumen del efluente tratado. Esto resulta ventajoso para fines prácticos, pues permite conocer la cantidad de volumen del efluente que se puede tratar antes de iniciar la operación (Vera y otros, 2018). Dado que el plomo (II) presentó la capacidad máxima de adsorción más alta en el material sintetizado, solo se estudió este elemento para los experimentos de adsorción dinámica. El flujo de alimentación de la CALE se operó de forma descendente por simplicidad (Figura 1a). En la Figura 7 se muestran las curvas de ruptura obtenidas a partir de los datos experimentales junto con las funciones de ajuste a los modelos mencionados.
En ambos casos es posible notar que el modelo de D-R se ajusta adecuadamente a los datos experimentales de adsorción de plomo (II) en todo el rango de volúmenes de efluente tratados. Este modelo permitió estimar la capacidad de adsorción para ambos experimentos bajo condiciones continuas. En el caso donde no hubo aplicación de magnetismo (Figura 7a), se obtuvo una capacidad de 9.649 , la cual es mayor a la obtenida para la remoción de plomo (II) en soluciones acuosas con otros materiales adsorbentes en trabajos previos. Por ejemplo, Vera y colaboradores (2018) realizaron un estudio hidrodinámico en una columna de lecho empacado de cáscaras de cacao en donde se obtuvo una capacidad de adsorción de 1.181 . Por otra parte, Valencia y Castellar (2013) analizaron la adsorción de este metal pesado en columnas empacadas con carbón activado granular con capacidades adsorbativas de hasta 0.50 . Lo anterior supone que el hecho de incorporar nanopartículas de magnetita a la biomasa representa una ventaja a nivel de eficiencia en adsorción continua. Para el caso donde hubo regeneración de adsorbente (Figura 7b), se obtuvo una capacidad de adsorción de 5.250 . Este resultado es menor al obtenido en la sección anterior en donde se utilizó el material fresco, este comportamiento fue esperado, pues se reutilizó el material, el cual, aunque no llegó a saturarse, ya había alcanzado más del 50% de la concentración inicial (Figura 7a). Aunque la capacidad adsorbativa se redujo casi a la mitad, sigue siendo mayor a las encontradas en la literatura para la remoción de plomo (II) en esquemas similares con otros materiales adsorbentes. Lo anterior indica que es posible regenerar el bioadsorbente magnético sintetizado mediante lavados simples con agua destilada, este proceso remueve parte del plomo (II) quedando como remanente en la superficie sólida del adsorbente en operaciones previas. Para evaluar el efecto del campo magnético se construyó la curva de ruptura en términos de la relación de volumen de carga tratada con respecto al volumen de adsorbente empleado (Figura 8).
Figura 8
Curvas de ruptura en términos de V tratados /V adsorbente.
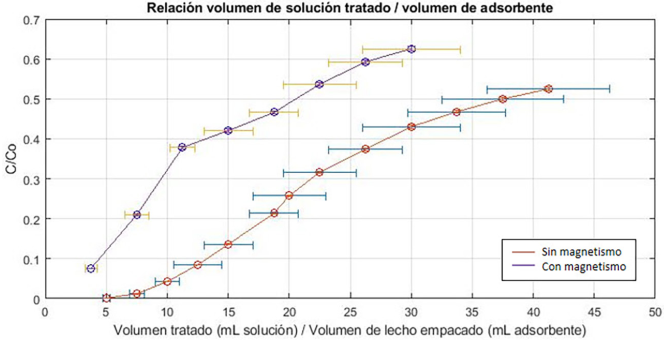
Fuente: Elaboración de las autoras.
Para el proceso de adsorción sin magnetismo se observa que, cuando la relación entre ambos volúmenes es de 10, se alcanza la ruptura (0.05% de la concentración a la entrada de la columna). Además, para el rango de volúmenes analizados, el lecho no se saturó y alcanzó aproximadamente el 53% de su concentración inicial. De hecho, según la predicción del modelo dosis-respuesta se estima que la saturación del lecho se alcanza aproximadamente al tratar 1400 mL de solución, lo cual representa 175 veces el volumen del lecho empacado. Por otro lado, cuando se aplica magnetismo y regeneración simultáneamente, se aprecia que, por efecto de la regeneración, la curva de ruptura comienza cuando la relación entre los volúmenes es de 4, para esta relación se alcanza el 7.55 % de la concentración inicial en el efluente de la columna. Si bien el lavado con agua no remueve por completo la cantidad de iones de plomo (II), sí realiza una mejora significativa en la recuperación y posterior desempeño del adsorbente. Para el rango de volúmenes estudiados, el lecho tampoco llegó a saturarse; sin embargo, se alcanzó una mayor concentración final (63% de la concentración inicial), en un menor número de volúmenes tratados, debido a que el adsorbente tuvo menores sitios activos disponibles para la captura de los iones de plomo (II). En efecto, según el modelo dosis-respuesta se estima que la saturación del lecho se alcanza al tratar aproximadamente 1500 mL de solución, lo cual representa 187 veces el volumen del lecho empacado. Es de hacer notar que la aplicación del campo magnético no cambia apreciablemente la forma de la curva de ruptura, pero sí tiene un efecto importante sobre los tiempos de ruptura y saturación, en la Tabla 6 se presentan estos parámetros para ambos casos.
Tabla 6
Parámetros de las curvas de ruptura para el plomo (II).
| Parámetro | Sin magnetismo | Con magnetismo |
|---|---|---|
| Tiempo de ruptura (± 0.5 min) | ||
| Tiempo de saturación (± 1.5 h) |
El tiempo de ruptura se redujo más del 50%, en tanto que el tiempo de saturación se incrementó casi en un 60%. Bajo las condiciones experimentales expuestas, se pudo remover una cantidad significativa de iones de plomo (II) utilizando una pequeña porción del bioadsorbente magnético. De esta manera, se comprueba que el material puede completar varios ciclos de adsorción, antes de llegar a saturarse y que la aplicación simultánea de un campo magnético externo permite alargar el tiempo de vida útil del material.
En cuanto al sistema por lotes, se presenta el porcentaje de remoción de los ciclos tratados (Figura 9a). Se observa que para los cuatro ciclos se alcanzaron tasas de remoción por encima del 90%. Particularmente, para el primer ciclo, el cual corresponde a la adsorción con el material fresco, se obtuvo el porcentaje de remoción más alto, aproximadamente del 99%, para un tiempo de contacto adsorbato-adsorbente de tan solo 2 horas. Posteriormente, la tasa de remoción se redujo gradualmente para estabilizarse en un 93%. Además, se muestra el efecto del tiempo de uso del adsorbente en la tasa de remoción alcanzada (Figura 9b). Las tasas de remoción más bajas se alcanzan a mayores tiempos de uso del adsorbente, debido a que a medida que se incrementan los ciclos, el bioadsorbente se gasta y se reducen sus sitios activos disponibles para la interacción con el adsorbato. Las tasas de remoción obtenidas entre los dos últimos ciclos fueron similares, debido a que, posiblemente el tiempo de contacto del tercer ciclo (18 horas) fue lo suficientemente grande como para que el adsorbente alcance la saturación. Este experimento buscaba hacer uso del bioadsorbente magnético simulando un tanque floculación, en donde el efecto de la captura de los metales pesados se da por el aumento del tiempo de contacto.
Figura 9
Tasas de remoción y concentración final alcanzadas en los sistemas por lotes.
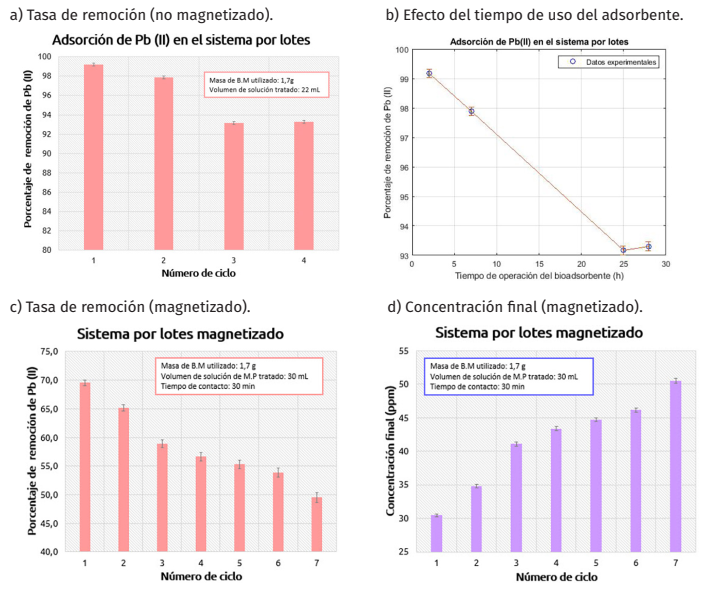
Fuente: Elaboración de las autoras.
En el sistema por lotes magnetizado se observa que en todos los ciclos se alcanzaron tasas de remoción de entre 69.5% hasta 49.5% (Figura 9c). Al igual que el sistema no magnetizado, la mayor tasa de remoción se registró en el primer ciclo (69.5%) para un tiempo de contacto adsorbato-adsorbente de 30 minutos. Aunque las tasas de remoción fueron menores a las obtenidas para el sistema no magnetizado, estos porcentajes representan un beneficio, desde el punto de vista de vida útil del material, se redujo más de 4 veces el tiempo de contacto y se aumentó la cantidad de ciclos analizados. Es importante mencionar que el material no alcanzó la saturación, pudiendo ser reutilizado para tratar una mayor cantidad de ciclos (Figura 9d).
Por último, en el arreglo de tubo WCOT, se tomó ventaja de las propiedades magnéticas del material para disponerlo de forma anular dentro de la columna y ponerlo en contacto con la solución de metales pesados. Se reporta el porcentaje de remoción alcanzado en los ciclos estudiados (Figura 10a). Se removió una cantidad importante de este ion de metal pesado en todos los ciclos, la tasa máxima se alcanzó en el primer ciclo (aproximadamente del 6%) para un tiempo de contacto adsorbato-adsorbente de tan solo 15 minutos, el cual se mantuvo constante para los primeros siete ciclos. En el segundo y tercer ciclo el porcentaje de remoción se reduce alrededor de un 10% con respecto al ciclo anterior, por efecto de la reutilización del material. Para el cuarto, quinto y sexto ciclos, la variación entre las tasas de remoción obtenidas es de aproximadamente el 5%. A partir del sexto ciclo, la variación en la tasa de remoción es muy pequeña entre ciclos. Aunque se incrementó al doble el tiempo de contacto para el ciclo ocho y nueve se notó que no hubo mayor efecto sobre el porcentaje de remoción, puesto que los valores continuaron con la tendencia mostrada en los ciclos anteriores hasta alcanzar una tasa de remoción cercana al 28.45% en el penúltimo ciclo. Para el último ciclo se incrementó el tiempo de contacto a 45 min, no obstante, tampoco hubo mejoría en la tasa de remoción, alcanzando un valor final de 27%. Asimismo, se reporta la concentración final obtenida en función del ciclo analizado (Figura 10b), se aprecia la existencia de una relación inversamente proporcional entre la tasa de remoción y la concentración final alcanzada en las soluciones. En el primer ciclo se alcanza la concentración final más baja y, posteriormente, esta aumenta gradualmente hasta estabilizarse en un valor cercano a las 71 ppm en los últimos ciclos.
Figura 10
Tasa de remoción y concentraciones finales alcanzada en el tubo WCOT.
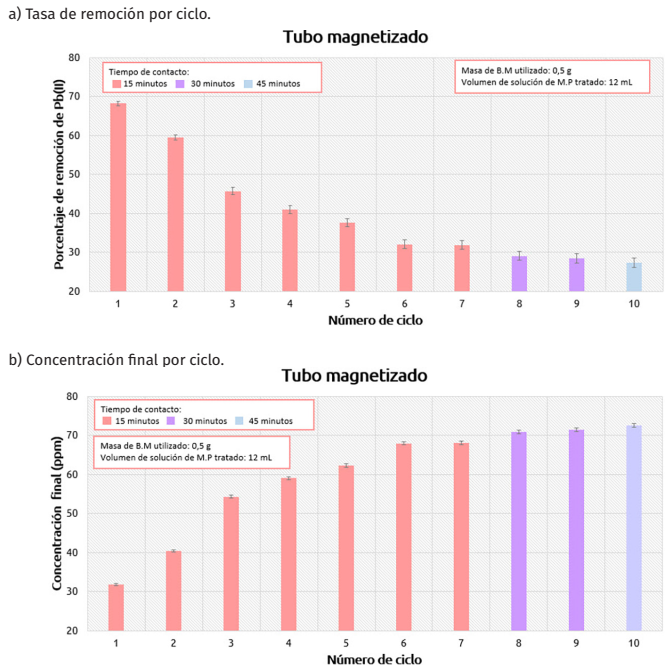
Fuente: Elaboración de las autoras.
Es importante considerar que, para esta experiencia se utilizó una cantidad de adsorbente muy pequeña y el tiempo de contacto fue corto con respecto a los otros experimentos. Este par de factores influyen significativamente en los resultados obtenidos. Al tener menor dosis de sólido, se reduce el número de sitios activos disponibles para la adsorción y, además, al ser un material reutilizado puede generarse el apilamiento de partículas, lo cual reduce aún más las zonas activas del bioadsorbente (Chen y otros, 2022). La mayor capacidad de adsorción registrada en este experimento fue la del primer ciclo, con un valor de 1.63 ; si bien este resultado es menor a la obtenida en la adsorción dinámica, sigue siendo un resultado aceptable para la cantidad de adsorbente utilizado. Incluso, este valor es superior a los reportados en trabajos previos: 1.181 (Vera y otros, 2018) y 0.50 (Valencia y Castellar, 2013) en sus investigaciones en sistemas del tipo adsorbedor empacado. Lo anterior permite inferir que el uso del campo magnético es de utilidad no solo para adherir el bioadsorbente a las paredes de la columna, sino también para mejorar el desempeño y capacidad de adsorción para con menores tiempos de contacto.
Comparación entre esquemas de adsorción
Con la finalidad de realizar una comparación apropiada de todos los esquemas de adsorción evaluados en la remoción de plomo (II), en la Tabla 7 se resumen diversos parámetros que permiten evaluar la eficiencia de cada arreglo en términos de la capacidad de adsorción, volumen de agua tratada con respecto a la dosis empleada de adsorbente, tiempo de contacto adsorbato-adsorbente y aplicación de un campo magnético (CM) externo.
Tabla 7
Comparación entre los esquemas de adsorción evaluados.
| Esquema | Tiempo de contacto (h) | CM externo | ||
|---|---|---|---|---|
| Adsorción en estático1 | 8.3 ± 0.2 | 93.9 | 22 | No |
| Columna empacada2 | 9.6 ± 0.2 | 122.2 | 5 ½ | No |
| Columna empacada con regeneración2 | 5.3 ± 0.1 | 88.9 | 5 | Sí |
| Sistema por lotes3 | 1.3 ± 0.1 | 12.9 | 2, 5, 18 y 7 | No |
| Sistema por lotes magnetizado3 | 1.2 ± 0.5 | 122.7 | ½ | Sí |
| Tubo recubierto WCOT3 | 1.6 ± 0.4 | 234.0 | ¼, ½ y – | Sí |
Se observa que, en general, los esquemas que alcanzaron la mayor capacidad de adsorción fueron el arreglo en columna empacada (con y sin regeneración) y la adsorción en estático cuyas capacidades fueron de 9.6 , 5.3 y 8.3 respectivamente. En particular, la CALE presentó la mayor relación de volumen de agua tratada con respecto a la dosis de adsorbente empleada (122.2 y 88.9 ). Si bien la operación en estático presentó una capacidad de adsorción alta, el tiempo de contacto fue mayor, este factor influyó notablemente en la capacidad de adsorción resultante.
Entre los esquemas de adsorción por lotes y el tubo WCOT se observó que las capacidades de adsorción tienen valores similares. Sin embargo, este último exhibió la mayor capacidad de adsorción (1.6 ) y relación entre los volúmenes de agua tratada con respecto a la dosis de adsorbente, la cual fue de 234.0 . Esta relación fue la más alta de los esquemas estudiados en este trabajo con tiempos de contacto relativamente bajos. Lo cual indica que este arreglo resulta eficiente para la remoción de plomo (II).
En cuanto a aquellos esquemas en donde se aplicó un campo magnético externo, se evidenció que la aplicación simultánea de magnetismo y regeneración en la CALE influyó en la obtención de una capacidad de adsorción alta (5.3 ), aun cuando se utiliza una dosis de adsorbente que ya ha sido gastado por un ciclo de operación previo. Además, la aplicación del campo magnético en el sistema por lotes generó una capacidad de adsorción similar a la obtenida con el mismo arreglo sin magnetismo con menor tiempo de uso del adsorbente y mayor relación de volumen de agua tratada con respecto a la dosis del material empleada, lo cual es ventajoso.
Los resultados permiten comprobar que a mayor tiempo de contacto se logran tasas/capacidades de adsorción más altas, pues se permite una mejor interacción entre el adsorbato-adsorbente. Por las razones expuestas anteriormente, se tomaron los arreglos de la columna empacada y el tubo WCOT como los esquemas más eficientes en términos de capacidad de adsorción y dimensiones de los equipos empleados. No obstante, desde el punto de vista práctico, el operador está en capacidad de seleccionar el criterio apropiado para seleccionar el mejor esquema de tratamiento en función del tiempo que se tenga disponible y la aplicación de dicha operación.
Caracterización del bioadsorbente usado mediante MEB-EDX
Se realizó con la finalidad de determinar la forma en la cual se adhirieron los iones de metales pesados en la superficie del material sintetizado. Se seleccionaron tres muestras provenientes de los esquemas de adsorción con mayor capacidad de remoción. En la Tabla 8 se resumen las microfotografías y el análisis EDX resultante. El código de identificación utilizado para cada muestra fue de:
A1:Porción de bioadsorbente utilizado en el esquema de adsorción dinámica (columna empacada).
A2:Porción de bioadsorbente utilizado en el esquema de adsorción estática del plomo (II).
A3:Porción de bioadsorbente utilizado en el esquema de adsorción estática del cromo (VI).
Tabla 8
Microfotografías y espectro EDX obtenido para las tres muestras de sólido usado.
En todas las muestras se aprecian zonas brillantes que corresponden a los metales presentes en el material sintetizado y zonas oscuras que corresponden a la biomasa base. En el espectro EDX se excluyeron algunos elementos como el carbono y metales alcalinos presentes en la composición original del Aloe vera. En las muestras A1 y A2 se detectó una composición atómica importante de plomo, lo cual indica que el material, efectivamente, logró adsorber iones de este metal pesado en la operación estática y dinámica. En la primera muestra se observaron pequeños aglomerados del metal sobre la base vegetal, en tanto que en la segunda se detectó la existencia de contenido de plomo tanto en la pared celular como en las regiones con cristales de magnetita. En la muestra A3 se detectó una pequeña proporción atómica de cromo. Este valor es menor a los obtenidos para el plomo en las muestras anteriores. Esto indica que, aunque el material presenta menor afinidad hacia este metal pesado, fue capaz de adsorber cierta cantidad de iones de cromo. En las tres muestras se detectó la presencia de los metales pesados en las cercanías de los framboides de magnetita, esto es un indicativo de haber una fuerte interacción entre el material magnético sintetizado y los iones de metales pesados (Foba-Tendo y otros, 2013).
Conclusión
El estudio de las propiedades adsortivas de los nanomateriales magnéticos comprende un campo novedoso y atractivo, pues permite la eliminación de contaminantes difíciles de remover a través de tratamientos tradicionales. A menudo se emplean desechos de la agroindustria, convirtiéndolos en una alternativa económicamente atractiva. En este trabajo se aplicaron las propiedades magnéticas de un bioadsorbente con nanopartículas de óxido de hierro para la remoción de metales pesados en soluciones acuosas. Se encontró que la incorporación de estas nanopartículas incrementa su capacidad de adsorción con respecto a otros materiales de biomasa reportados en la literatura, lo cual permite su aplicación en diferentes esquemas de adsorción, mostrando gran versatilidad. Se comprobó también la posibilidad de remover una cantidad importante de iones de metales pesados en todos los esquemas de adsorción evaluados y, además, se verificó que el material presenta mayor afinidad hacia el plomo (II). Por último, se verificó que la regeneración con aplicación simultánea de magnetismo influye significativamente en el desempeño y tiempo de vida útil del adsorbente.
Referencias
Benítez, R., S. Pabón, R. Sarria-Villa y J. Gallo. (2020). Contaminación del agua por metales pesados, métodos de análisis y tecnologías de remoción: una revisión. Entre ciencia e ingeniería. Scielo-EPub, 14(27): 9-18. https://doi.org/10.31908/19098367.0001.
R. Benítez S. Pabón R. Sarria-Villa J. Gallo 2020Contaminación del agua por metales pesados, métodos de análisis y tecnologías de remoción: una revisión. Entre ciencia e ingenieríaScielo-EPub142791810.31908/19098367.0001
Bilal, M., I. Ihsanullah, M. Younas y M. Hassan. (2021). Recent advances in applications of low-cost adsorbents for the removal of heavy metals from water: a critical review. Separation and Purification Technology, 278. https://doi.org/10.1016/j.seppur.2021.119510.
M. Bilal I. Ihsanullah M. Younas M. Hassan 2021Recent advances in applications of low-cost adsorbents for the removal of heavy metals from water: a critical reviewSeparation and Purification Technology27810.1016/j.seppur.2021.119510
Brown, P., S. Grill y S. Allen. (2000). Metal removal from wastewater using peat. Water Research, 34(16): 3907-3916. http://dx.doi.org/10.1016/S0043-1354(00)00152-4.
P. Brown S. Grill S. Allen 2000Metal removal from wastewater using peatWater Research34163907391610.1016/S0043-1354(00)00152-4
Cai, D., T. Zhang y X. Luo. (2017). Quaternary ammonium β-cyclodextrin-conjugated magnetic nanoparticles as nano-adsorbents for the treatment of dyeing wastewater: synthesis and adsorption studies. Journal of Environmental Chemical Engineering, 5(3): 2869-2878. https://doi.org/10.1016/j.jece.2017.06.001.
D. Cai T. Zhang X. Luo 2017Quaternary ammonium β-cyclodextrin-conjugated magnetic nanoparticles as nano-adsorbents for the treatment of dyeing wastewater: synthesis and adsorption studiesJournal of Environmental Chemical Engineering532869287810.1016/j.jece.2017.06.001
Caviedes, D. I., R. R. Muñoz, A. Perdomo, D. Rodríguez y L. J. Sandoval. (2015). Tratamientos para la remoción de metales pesados comúnmente presentes en aguas residuales industriales. Una revisión. Ingeniería y Región, (13): 73-90. https://doi.org/10.25054/22161325.710.
D. I. Caviedes R. R. Muñoz A. Perdomo D. Rodríguez L. J. Sandoval 2015Tratamientos para la remoción de metales pesados comúnmente presentes en aguas residuales industriales. Una revisiónIngeniería y Región13739010.25054/22161325.710
Chang, Y. C. y D. H. Chen. (2005). Preparation and adsorption properties of monodisperse chitosan-bound Fe3O4 magnetic nanoparticles for removal of Cu(II) ions. Journal of Colloid and Interface Science, 283(2): 446-451. https://doi.org/10.1016/j.jcis.2004.09.010.
Y. C. Chang D. H. Chen 2005Preparation and adsorption properties of monodisperse chitosan-bound Fe3O4 magnetic nanoparticles for removal of Cu(II) ionsJournal of Colloid and Interface Science283244645110.1016/j.jcis.2004.09.010
Chen, X., M. Faysal, D. Chengyu, J. Lu, Y. Fai, M. Shoffikul y Y. Zhou. (2022). Isotherm models for adsorption of heavy metals from water - A review. Chemosphere, 307(1). https://doi.org/10.1016/j.chemosphere.2022.135545.
X. Chen M. Faysal D. Chengyu J. Lu Y. Fai M. Shoffikul Y. Zhou 2022Isotherm models for adsorption of heavy metals from water - A reviewChemosphere307110.1016/j.chemosphere.2022.135545
De León, J., V. Reyes, E. Hernández, S. Pérez, L. Hurtado y B. Landeros. (2019). Synthesis and characterization of magnetite nanoparticles for photocatalysis of nitrobenzene. Journal of Saudi Chemical Society, 24(2): 223-235. King Saud University. https://doi.org/10.1016/j.jscs.2019.12.004.
J. De León V. Reyes E. Hernández S. Pérez L. Hurtado B. Landeros 2019Synthesis and characterization of magnetite nanoparticles for photocatalysis of nitrobenzeneJournal of Saudi Chemical Society242223235King Saud University10.1016/j.jscs.2019.12.004
El-Dib, F., D. Mohamed, O. El-Shamy y M. Mishrif. (2020). Study the adsorption properties of magnetite nanoparticles in the presence of different synthesized surfactants for heavy metal ions removal. Egyptian Journal of Petroleum, 29: 1-7. https://doi.org/10.1016/j.ejpe.2019.08.004.
F. El-Dib D. Mohamed O. El-Shamy M. Mishrif 2020Study the adsorption properties of magnetite nanoparticles in the presence of different synthesized surfactants for heavy metal ions removalEgyptian Journal of Petroleum291710.1016/j.ejpe.2019.08.004
Femenia, A., E. Sánchez, S. Simal y C. Roselló. (2017). Compositional features of polysaccharides from Aloe vera (Aloe Barbadensis Miller) plant tissues. Carbohydrate Polymers, 39(2): 109-117. https://doi.org/10.1016/S0144-8617(98)00163-5.
A. Femenia E. Sánchez S. Simal C. Roselló 2017Compositional features of polysaccharides from Aloe vera (Aloe Barbadensis Miller) plant tissuesCarbohydrate Polymers39210911710.1016/S0144-8617(98)00163-5
Foba-Tendo, J., J. Namanga, N. Yufanyi y W. Krause. (2013). A one pot green synthesis and characterisation of iron oxide-pectine hybrid nanocomposites. Open Journal of Composite Material, 3: 30-37. https://doi.org/10.4236/OJCM.2013.32005.
J. Foba-Tendo J. Namanga N. Yufanyi W. Krause 2013A one pot green synthesis and characterisation of iron oxide-pectine hybrid nanocompositesOpen Journal of Composite Material3303710.4236/OJCM.2013.32005
García, V., A. Yipmantin, E. Guzmán, R. Pumachaga y H. Maldonado. (2011). Estudio de la cinética de biosorción de iones plomo en pectina reticulada proveniente de cáscaras de cítricos. Revista de la Sociedad Química del Perú, 77(3): 173-181.
V. García A. Yipmantin E. Guzmán R. Pumachaga H. Maldonado 2011Estudio de la cinética de biosorción de iones plomo en pectina reticulada proveniente de cáscaras de cítricosRevista de la Sociedad Química del Perú773173181
Giraldo, L., A. Erto y J. Moreno. (2013). Magnetite nanoparticles for removal of heavy metals from aqueous solutions: synthesis and characterization. Adsorption, 19: 465-474. https://doi.org/10.1007/s10450-012-9468-1.
L. Giraldo A. Erto J. Moreno 2013Magnetite nanoparticles for removal of heavy metals from aqueous solutions: synthesis and characterizationAdsorption1946547410.1007/s10450-012-9468-1
Guerra, J. y A. Portillo. (2018). Estudio de las propiedades del sistema magnetita-pectina como adsorbente de metales en agua. Jornadas de investigación, Facultad de Ingienieria, Universidad Central de Venezuela.
J. Guerra A. Portillo 2018Estudio de las propiedades del sistema magnetita-pectina como adsorbente de metales en aguaJornadas de investigaciónFacultad de Ingienieria, Universidad Central de Venezuela
Jixiang, L., B. Jiang, Y. Liu, C. Qiu, H. Jiajun, G. Qian, W. Gou y H. Nao Ngo. (2017). Preparation and adsorption properties of magnetic chitosan composite adsorbent for Cu2+ removal. Journal of Cleaner Production, 158: 51-58. https://doi.org/10.1016/j.jclepro.2017.04.156.
L. Jixiang B. Jiang Y. Liu C. Qiu H. Jiajun G. Qian W. Gou H. Nao Ngo 2017Preparation and adsorption properties of magnetic chitosan composite adsorbent for Cu2+ removalJournal of Cleaner Production158515810.1016/j.jclepro.2017.04.156
Lu, An-Hui, E. L. Salabas y Ferdi Schuth. (2007). Magnetic nanoparticles: synthesis, protection, functionalization, and application. Angewandte Chemie (International ed. in English), 46(8): 1222-1244. https://doi.org/10.1002/anie.200602866.
An-Hui Lu E. L. Salabas Ferdi Schuth 2007Magnetic nanoparticles: synthesis, protection, functionalization, and applicationAngewandte ChemieEnglish4681222124410.1002/anie.200602866
Matmin, J., I. Affendi, S. Ilyana y S. Endud. (2018). Additive free rice starch-assisted synthesis of spherical nanostructured hematite for degradation of dye contaminant. Nanomaterials, 8(9). https://doi.org/10.3390/nano8090702.
J. Matmin I. Affendi S. Ilyana S. Endud 2018Additive free rice starch-assisted synthesis of spherical nanostructured hematite for degradation of dye contaminantNanomaterials8910.3390/nano8090702
Meza-Gaspar, T., R. Castillo-Zamudio, H. Váquiro-Herrera, I. Paniagua-Martínez, C. Ozuna y E. Corona-Jiménez. (2017). Obtención de pectina de guayaba (Psidium Guajava L.Var. Media China) mediante hidrólisis ácida asistida con ultrasonido de alta intensidad. Investigación y Desarrollo en Ciencia y Tecnología de Alimentos, 2: 575-581.
T. Meza-Gaspar R. Castillo-Zamudio H. Váquiro-Herrera I. Paniagua-Martínez C. Ozuna E. Corona-Jiménez 2017Obtención de pectina de guayaba (Psidium Guajava L.Var. Media China) mediante hidrólisis ácida asistida con ultrasonido de alta intensidadInvestigación y Desarrollo en Ciencia y Tecnología de Alimentos2575581
Rojas, Y. y C. Zarate. (2015). Efecto del pH y el tiempo de contacto en la adsorción de cromo hexavalente en solución acuosa utilizando montmorillonita como adsorbente. Repositorio Institucional de la UNCP. https://repositorio.uncp.edu.pe/handle/20.500.12894/1012.
Y. Rojas C. Zarate 2015Efecto del pH y el tiempo de contacto en la adsorción de cromo hexavalente en solución acuosa utilizando montmorillonita como adsorbenteRepositorio Institucional de la UNCPhttps://repositorio.uncp.edu.pe/handle/20.500.12894/1012
Solomon, O., K. Adesina, A. Abiola y H. Abdualazeez. (2013). Dye adsorption using biomass wastes and natural adsorbents. Desalination and Water Treatment, 53(5): 1-29. http://dx.doi.org/10.1080/19443994.2013.862028.
O. Solomon K. Adesina A. Abiola H. Abdualazeez 2013Dye adsorption using biomass wastes and natural adsorbentsDesalination and Water Treatment53512910.1080/19443994.2013.862028
Toma, H. (2015). Magnetic nanohydrometallurgy: a nanotechnological approach to elemental sustainability. Green Chem., 17: 2027-2041. https://doi.org/10.1039/C5GC00066A.
H. Toma 2015Magnetic nanohydrometallurgy: a nanotechnological approach to elemental sustainabilityGreen Chem.172027204110.1039/C5GC00066A
Valencia, J. y C. Castellar. (2013). Predicción de las curvas de ruptura para la remoción de plomo (II) en disolución acuosa sobre carbón activado en una columna empacada. Revista de la Facultad de Ingeniería de la Universidad de Antioquia, 66: 141-158.
J. Valencia C. Castellar 2013Predicción de las curvas de ruptura para la remoción de plomo (II) en disolución acuosa sobre carbón activado en una columna empacadaRevista de la Facultad de Ingeniería de la Universidad de Antioquia66141158
Vera, M., D. Bermejo, M. Uguña, N. García, M. Flores y D. Brazales. (2018). Modelado de columna de lecho fijo para la bioadsorción de Cd+2 y Pb+2 con cáscaro de cacao. Revista Internacional de Contaminación Ambiental, 4(34): 611-620. https://doi.org/10.20937/RICA.2018.34.04.05.
M. Vera D. Bermejo M. Uguña N. García M. Flores D. Brazales 2018Modelado de columna de lecho fijo para la bioadsorción de Cd+2 y Pb+2 con cáscaro de cacaoRevista Internacional de Contaminación Ambiental43461162010.20937/RICA.2018.34.04.05
Zhao, J., R. Boada, G. Cibin y C. Palet. (2021). Enhancement of selective adsorption of Cr species via modification of pine biomass. Science of The Total Environment, 756. https://doi.org/10.1016/j.scitotenv.2020.143816.
J. Zhao R. Boada G. Cibin C. Palet 2021Enhancement of selective adsorption of Cr species via modification of pine biomassScience of The Total Environment75610.1016/j.scitotenv.2020.143816
Notes
[1] Agradecemos al profesor Jean González del Laboratorio de Residuales de Carbón, los licenciados Alicia Benítez y Gleen Rodríguez del Laboratorio E de la Universidad Simón Bolívar (USB) y al doctor Rodolfo Vargas del Laboratorio de Estructura Molecular del Instituto de Estudios Avanzados (IdEA), por facilitar los equipos necesarios para obtener los resultados de este trabajo.