Introducción
Los avances médicos han incrementado la esperanza de vida en los humanos a nivel mundial. La vida longeva que se alcanza hoy en día supera con mayor frecuencia los 80 años y en México la pirámide poblacional indica la posibilidad de haber un mayor número de personas de la tercera edad en las siguientes décadas, en las cuales las afecciones y enfermedades asociadas con el tejido óseo están generalmente presentes en esta etapa de la vida. Aunado a esto, existen traumatismos promoviendo la pérdida ósea y para los cuales, desafortunadamente hoy en día, no se cuenta con una terapia 100% exitosa. Lo anterior, junto con la presencia de nuevos retos en el campo de la salud han impulsado el desarrollo de nuevos nanomateriales y nanofármacos buscando resolver los desafíos médicos a presentarse en el campo de la regeneración ósea.
En la mayoría de las investigaciones biomédicas predomina el uso de cultivos bidimensionales (2D o monocapa) debido a ser una técnica común para simular el crecimiento y desarrollo de los indistintos linajes celulares, sin embargo, recientemente se ha mostrado un interés creciente en tener cultivos celulares imitando las características arquitectónicas y fisiológicas observándose en los distintos tejidos que constituyen al cuerpo humano.
Existen diferentes campos incorporando la ingeniería de tejidos, entre ellos la regeneración ósea, por lo cual el uso de cultivos tridimensionales (3D) como los esferoides ha tomado relevancia. Estos modelos de estudio ofrecen el autoensamblaje célula-célula e interacción célula matriz extracelular, creando un microambiente celular muy similar al de los tejidos de origen. Esta propuesta de cultivo es prometedora como modelo de estudio, generando osteoesferoides que permitan observar con mayor precisión los efectos de los nanofármacos y/o nanomateriales en el proceso de regeneración y de mineralización.
El hueso es un tejido multifacético. Participa en muchas funciones, como la locomoción incluido el equilibrio, participa activamente en la regulación del calcio y fosfato mediada por hormonas, la protección de los órganos (Cappariello, Ponzetti, y Rucci, 2016), y también actúa como un reservorio de la médula ósea. A pesar de estar mineralizado y de alguna manera percibirse como “inmutable”, el hueso es en realidad muy dinámico y activo, especialmente durante el crecimiento (Ponzetti y Rucci, 2021). Este está protegido por masa muscular, sin embargo, ello no evita su exposición a diversos factores físicos, genéticos, ambientales, nutricionales, etc., los cuales pueden afectar su integridad y función (Hart et al., 2020; Florencio-Silva et al., 2015).
El hueso está compuesto por tejido conectivo especializado mineralizado proveniente del mesodermo, así como otros tejidos derivados del mesénquima embrionario, incluidos el tejido hematopoyético y el tejido adiposo, también encontramos vasos sanguíneos y nervios. El tejido óseo exhibe cuatro tipos de células en una estrecha relación con su matriz mineralizada: osteoblastos, células de revestimiento óseo, osteocitos y osteoclastos; todas ellas, le darán la propiedad de ser un órgano altamente dinámico continuamente reabsorbido por osteoclastos y nuevamente formado por osteoblastos (Florencio-Silva et al., 2015; Seeman y Delmas, 2006; Sánchez Escamilla, 2021).
El microambiente celular regulado endocrinamente junto con citoquinas y factores de crecimiento llevándose a cabo en el hueso promueve mecanismos de señalización en células mesenquimales, induciendo su replicación y diferenciación hacia linajes osteoblásticos u osteoclásticos. Los osteoblastos son los responsables de mantener la integridad y formar los huesos, es por ello la importancia de su actividad sintética y reguladora (Rosenberg, Rosenberg y Soudry, 2012).
Los osteoblastos son los responsables de la osteogénesis (u osificación). Estas células son metabólicamente muy activas, sintetizan y depositan proteínas orgánicas de la matriz ósea (osteoides), las cuales se mineralizarán tanto en los esqueletos en desarrollo como durante el proceso de remodelación ósea que ocurre continuamente a lo largo de la vida de un individuo (Henry y Bordoni, 2024). El osteoblasto también ayuda en la mineralización de este osteoide óseo recién formado. En los procesos de mineralización, las vesículas provenientes de los osteoblastos localizadas en el osteoide liberan fosfato localmente, el cual junto con el calcio extracelular propician el proceso de nucleación de la hidroxiapatita. La proporción correcta de matriz orgánica y mineral es crucial para garantizar el equilibrio adecuado entre rigidez y flexibilidad de los huesos (Katsimbri, 2017).
El campo de la bioingeniería de tejidos busca usar nanoestructuras, nanomateriales y nanofármacos compatibles biológicamente con estirpes celulares como el osteoblasto con la finalidad de potenciar sus características y utilizarlos en la terapia regenerativa. La medicina regenerativa o bioingeniería de tejidos es un campo relativamente nuevo que utiliza células vivas, materiales biocompatibles y factores bioquímicos (por ejemplo, factores de crecimiento) y físicos (por caso, carga mecánica cíclica) adecuados, así como combinaciones de estos, para crear estructuras similares a tejidos. Con mayor frecuencia, su objetivo principal es la implantación de estas construcciones de tejido en el cuerpo para reparar una lesión o remplazar la función de un órgano defectuoso. Hoy en día, la medicina regenerativa se enfoca en el desarrollo del soporte vital extracorpóreo especializado en sistemas conteniendo células (hígado y riñón bioartificiales, por mencionar algunos). Además de sus aplicaciones clínicas, otros usos incluyen pruebas de fármacos para eficacia y toxicología, así como estudios básicos sobre el desarrollo y morfogénesis de tejidos (Berthiaume, Maguire y Yarmush, 2011; Jalali, Saldanha y Jalali, 2017; Sánchez Escamilla, 2021).
La bioingeniería de tejidos tiene como objetivo proporcionar técnicas alternativas para la regeneración de tejidos. Actualmente, esta disciplina tiene tres principios básicos aplicados normalmente para este fin: el uso de andamios en forma de un biomaterial diseñado para imitar las propiedades físicas de la matriz extracelular del tejido, al tiempo de proporcionar apoyo funcional para iniciar formación tisular; el cultivo de células en la superficie de andamios para adherir y colonizar el área a regenerar in vitro / in vivo, y, la provisión de factores de crecimiento para dirigir el destino celular a través de la proliferación y diferenciación (Roi et al., 2019; Sánchez Escamilla, 2021).
Tradicionalmente, los cultivos celulares en modelos bidimensionales son utilizados por su fácil mantenimiento y bajo costo en cuanto a la realización de ensayos de rutina, desafortunadamente en este método de cultivo, las interacciones célula-célula, así como célula-MEC no son representativas como lo serían in vivo, sin mencionar la pérdida de la polaridad tras su crecimiento adherente, lo cual cambia significativamente su respuesta ante procesos de comunicación. La comunicación celular es responsable de la diferenciación, proliferación, viabilidad y la expresión de genes y proteínas, por lo tanto, las alteraciones presentadas por las células en modelos bidimensionales y sus desventajas han sido motivo de la implementación de modelos de cultivo alternativos (Edmondson et al., 2014; Kapałczyńska et al., 2018; Gurumurthy, Bierdeman y Janorkar, 2017; Sánchez Escamilla, 2021).
La generación de esferoides se basa en el principio básico común del autoensamblaje. Durante el desarrollo embrionario, las células se someten a un autoensamblaje biológico para formar tejidos complejos con arquitectura 3D y contactos intensivos entre células. Estos contactos son importantes para mantener las funciones intracelulares, pues es el microambiente el que contiene una distribución específica de oxígeno, nutrientes y metabolitos, además de proveer señales las cuales activan mecanismos de señalización cruciales para una respuesta celular específica, con la finalidad de mantener la homeostasis y preservar la vida (Laschke y Menger, 2017; Whitesides y Grzybowski, 2002; Sánchez Escamilla, 2021).
Los esferoides imitan los procesos naturales ocurridos durante la embriogénesis, morfogénesis y organogénesis. Por lo tanto, estos pueden imitar las características arquitectónicas y funcionales del tejido a reproducir; por ejemplo, se ha reportado que los esferoides de los cardiomiocitos laten con un ritmo similar al del corazón (Baptista, 2018; Langdon, 2003; Sánchez Escamilla, 2021).
Cabe mencionar que las células en cultivos tridimensionales se mantienen comunicadas entre ellas y con proteínas de la matriz extracelular en todas las dimensiones a diferencia de las células cultivadas en monocapa (2D). Esto mantiene un mayor contacto intercelular y favorece que la matriz extracelular actúe como andamio y modulador de crecimiento, proliferación y diferenciación celular (Baptista, 2018; Achilli, Meyer y Morgan, 2012; Sánchez Escamilla, 2021).
Este microambiente es de gran relevancia pues funciona como medio de señalización bioquímica y acoplamiento intercelular influyendo en la forma celular, motilidad, proliferación y diferenciación, así como en la expresión de biomarcadores (Achilli, Meyer y Morgan, 2012; Sánchez Escamilla, 2021).
Existen varios reportes indicando los cambios que se suceden en los modelos tridimensionales. Algunos autores indican el tener estas estructuras avasculares limitaciones de difusión, particularmente O2 en estructuras de hasta 200 μm, incluso se indica haber un transporte masivo ineficiente conduciendo la acumulación de desechos metabólicos, por lo cual un tamaño superior a 500 μm de diámetro suele mostrar una estructura en forma de capa comprendiendo un núcleo necrótico rodeado por un borde viable, el cual consta de una capa interna de células inactivas o quiescentes y una capa externa de células en proliferación; sin embrago, en otras propuestas se observa el cocultivo con células endoteliales creando un ambiente favorecedor de la microvasculatura (Hu y Li, 2007; Curcio et al., 2007; Lin y Chang, 2008; Fennema et al., 2013; Sánchez Escamilla, 2021).
La bioingeniería de tejido óseo se basa en el uso de células como alternativas viables a los injertos óseos, materiales sintéticos y enfoques farmacológicos, incrementándose día a día. En comparación con las células individuales, la agregación de células en esferoides sin centros necróticos da como resultado una mayor viabilidad celular, junto con un mayor potencial proangiogénico, antinflamatorio y de formación de tejidos Además, el trasplante de células utilizando materiales de ingeniería permite la entrega localizada en el sitio objetivo, al tiempo de brindar la oportunidad de guiar el destino celular in situ, lo cual deriva en mejores resultados terapéuticos en comparación con la inyección sistémica o localizada (Gionet-Gonzales y Leach, 2018; Sánchez Escamilla, 2021).
En el campo de la regeneración ósea, se ha demostrado que los esferoides tienen una diferenciación osteogénica acelerada in vitro en comparación con el cultivo en monocapa, se ha observado que los osteoblastos sufren un complejo proceso de diferenciación en el cual las células cambian su morfología fibroblastoide a una forma cuboidal y comienzan a producir matriz extracelular típica del tejido óseo, con colágeno tipo I y varias proteínas específicas como OP y OC (Baptista, 2018; Langdon, 2003; Achilli, Meyer y Morgan, 2012; Sánchez Escamilla, 2021).
Existen diferentes técnicas para la formación de esferoides, una de ellas es el cultivo en suspensión. Esta técnica consiste en el uso de superficies tratadas sin permitir la adherencia de las células a la superficie de las cajas de cultivo. Existe una gran controversia sobre este tipo de cultivo tridimensional, debido a haberse observado diferencias considerables en el tamaño y forma de los esferoides, mostrando un cultivo muy heterogéneo. Estudios describen que las características en la morfología de los esferoides están relacionadas con el tipo de cultivo que se utilice para cada propósito (Cesarz y Tamama, 2016; Ryu, Lee y Park, 2019; Poornima et al., 2022).
En este trabajo se identifican las características de los osteoesferoides cuando crecen en condiciones de suspensión y la capacidad que tienen para formar mineralización.
Metodología
Cultivo bidimensional (monocapa). Se utilizó la línea celular establecida de osteoblastos fetales humanos hFOB 1.19 CRL-3602 (obtenidas de American Type Culture Collection, Manassas, VA, USA). Las células se sembraron en frascos de 25 cm3 (Corning Incorporated®, Corning, NY, USA), permitiendo la adhesión de las células a la superficie. Se crecieron en medio de cultivo Dulbecco’s Modified Eagle Medium: Nutrient Mixture F-12 (DMEM/F12), suplementado con 10% de suero bovino fetal (SBF) y 1X antibiótico-antimicótico (Gibco, Thermo Fisher Scientific), se incubaron a 37 ºC, 90% de humedad y atmósfera con 5% de CO2. El medio de cultivo fue remplazado por medio fresco cada tercer día.
Cultivo tridimensional (3D) en suspensión. A los cultivos en monocapa con una confluencia del 75% se les retiro el medio y se lavaron con PBS1X (0.14 M NaCl, 3mM KCl, 8.1 mM NaH2PO4, 10 mM Na2HPO4, 1.5 mM KH2PO4, a pH 7.3) (JT Baker-Fisher Scientific, UK); se utilizó tripsina-EDTA 1X y se obtuvo una suspensión celular homogénea en medio DMEM/F12 libre de suero y suplementos. Se determinó la concentración y viabilidad celular con cámara de New Bauer (BOECO, IMLAB) y azul tripano al 4% (Sigma Aldrich Corporation Chicago, USA).
En cajas de ultra baja adherencia (Corning Incorporated®, Corning, NY, USA); se sembraron [5 × 102], [1 × 103], [2 × 103], [3 × 103], [4 × 103], [6 × 103], [8 × 103] y [10 × 103] células/mL para determinar cuál concentración favorece la formación y eficiencia en el número de osteoesferoides de tamaño homogéneo, dentro de un rango de 100 a 150 µM y sin coagregados celulares. Con la finalidad de propiciar el enriquecimiento de los esferoides en poblaciones celulares con características de troncalidad, el medio de cultivo consistió en DMEM/F12 al 10% con sustituto de suero KnockOut™ (Gibco, Thermo Fisher Scientific), suplementado con factor de crecimiento epidermal (EGF), factor de crecimiento fibroblástico básico (bFGF) (BioLegend San Diego, CA USA). Se incubaron a 37 ºC, 90% de humedad y atmósfera con 5% de CO2. Se observó bajo microscopio invertido la formación de los osteoesferoides durante los días 1, 3 y 5 de crecimiento.
A partir de los resultados de la formación de los osteoesferoides a diferentes concentraciones durante 5 días se realizaron cultivos en suspensión durante 3, 7, 14 y 21 días, utilizando concentraciones de [5 × 102], [1 × 103], [2 × 103], [3 × 103], [4 × 103], [6 × 103] células/mL para poder determinar la capacidad de mineralización de estas estructuras.
De acuerdo con los resultados del ensayo, se tomaron fotografías a aumentos de 4, 10 y 25X, y se evaluó el tamaño de las esferas formadas mediante la adquisición de imágenes analizadas a través del programa ImageJ.
Ensayo de viabilidad celular por exclusión de azul tripano. Para determinar la viabilidad celular de los osteoesferoides a partir de cultivos en suspensión, se recolectaron los osteoesferoides por centrifugación y se lavaron en tres ocasiones con PBS1X. El concentrado de osteoesferoides fue resuspendido en 1 mL de PBS 1X para disgregarlos y obtener una suspensión celular homogénea. Se determino viabilidad celular, utilizando una cámara de Neubauer y azul tripano al 4%.
Con la finalidad de observar la distribución celular viable en los osteoesferoides, estos se concentraron por centrifugación y se lavaron con PBS 1X en tres ocasiones. La distribución de células viables en los osteoesferoides, determinada por exclusión de azul tripano, se observó bajo microscopio invertido y se tomaron fotografías a un aumento 25X.
Tinción hematoxilina & eosina (H&E). Con la finalidad de observar las características celulares de los osteoesferoides en los cuales se pueden encontrar centros necróticos y habiendo seleccionado la concentración celular por mL que mostraba mejores condiciones para la formación de los mismos, que fue de [5 × 102] células/mL, a partir de cultivos en suspensión a 7, 14 y 21 días, se recolectaron los osteoesferoides por centrifugación y se lavaron en tres ocasiones con PBS 1X y se fijaron con paraformaldehído (PFA) al 4% (Científica Senna, USA). Se trataron con diferentes concentraciones de alcoholes y xilol para embeberlas en parafina. De los bloques obtenidos se realizaron cortes de 4 µm y se montaron en laminillas electrocargadas (Merck Millipore KGaA, Darmstadt, Alemania), para su posterior tinción con H&E. Las laminillas teñidas se montaron con Entellan® (Merck Millipore KGaA, Darmstadt, Alemania) y se cubrieron con cubreobjetos, se observaron al microscopio invertido y se tomaron fotografías a un aumento 25X.
Ensayo clonogénico. Después de observar las características celulares de los osteoesferoides y utilizando la concentración [5 × 102] células/mL, se determinó el efecto del medio de cultivo que induce la formación de nódulos mineralizados en estas estructuras. Se realizaron ensayos libres de anclaje, que permitieran observar la formación y tamaño de colonias por crecimiento clonal, esto en condiciones basales y con medio inductor. Para los cultivos libres de anclaje se preparó una solución 1:1 de agar al 6% y al 1% en DMEM 2X (medio basal) y DMEM 2X + β-glicerofosfato [10 mM] + ácido ascórbico [50 µg/ml] (Sigma Aldrich Corporation Chicago) (medio inductor de mineralización). Ambos medios suplementados con 10% SBF y antibiótico antimicótico [1X].
En cajas adherentes se colocó la solución tibia y líquida de agar al 6% y se dejó gelificar a temperatura ambiente, posteriormente, sobre esta se agregó la solución del agar al 1% (solución semilla) conteniendo [5 × 102] células/mL. Se dejo gelificar la solución semilla e inmediatamente se adicionó el medio de cultivo. Tanto el ensayo clonogénico en condiciones basales como con el medio inductor, se dejaron durante 3, 7 y 14 días y se agregó medio de cultivo fresco cada tercer día. Al final de los ensayos estos se fijaron con metanol y se tiñeron con cristal violeta al 0.05%. Se contaron manualmente las clonas formadas en 3 campos diferentes por condición observadas a 4X en un microscopio invertido.
Ensayos de tinción con alizarina roja. Con la finalidad de observar la formación de nódulos mineralizados por la deposición de calcio, se llevaron a cabo ensayos a 3, 7 y 14 días en cultivos en suspensión y cultivos bidimensionales, utilizando una concentración [5 × 102] células/mL y 1 × 105 células por pozo respectivamente, tanto con medio basal como con medio inductor.
A partir de cultivos en suspensión se recolectaron los osteoesferoides por centrifugación y se lavaron en tres ocasiones con PBS 1X y se fijaron con paraformaldehído al 4% en PBS 1X por 10 minutos, posteriormente, se realizó la tinción con una solución de alizarina roja al 2% (Sigma Aldrich Corporation Chicago, USA) durante 2 horas a temperatura ambiente, al término se realizaron lavados con PBS 1X, y finalmente se lavaron con agua desionizada para observar bajo microscopio invertido.
Como control positivo de la formación de nódulos mineralizados, se utilizaron cultivos bidimensionales, los cuales se mostraron a una confluencia del 75%, se fijaron con PFA al 4% y se realizó la tinción con alizarina roja mediante el procedimiento antes mencionado.
Resultados
Análisis estadístico
Los datos presentados corresponden a la media ± error estándar del número de observaciones (n = 3). Las comparaciones estadísticas se realizaron por la prueba ANOVA seguido por el análisis de Tukey-Kramer o Fisher utilizando Excel. Las diferencias entre las medias se consideraron significativas cuando p < 0.05.
Formación de osteoesferoides de la línea celular hFOB 1.19
Para poder determinar la concentración de células/mL que generan las formaciones de osteoesferas, primero se observaron las características de crecimiento de estas en la línea celular, los datos mostraron que estas células en condiciones de adherencia forman monocapas homogéneas, estables, viables y con alta capacidad proliferativa. Bajo condiciones de cultivo en suspensión y a lo largo de 5 días y a diferentes concentraciones, se forman estructuras esféricas a partir de las 24 horas, esto se observa en todas las condiciones del ensayo mostrando, sin embargo, la heterogeneidad en la forma y tamaño de los osteoesferoides incrementa y es dependiente de la concentración creciente de las células utilizadas para cada condición, además, se observa también la presencia de coagregados celulares a mayor concentración, siendo [8 × 103], [10 × 103] células/mL donde se presenta esta característica (Figura 1).
Figura 1
Fotomicrografía (25X) de la formación de esferoides de las líneas celulares hFOB 1.19. (osteoblastos) a diferentes concentraciones celulares durante 5 días.
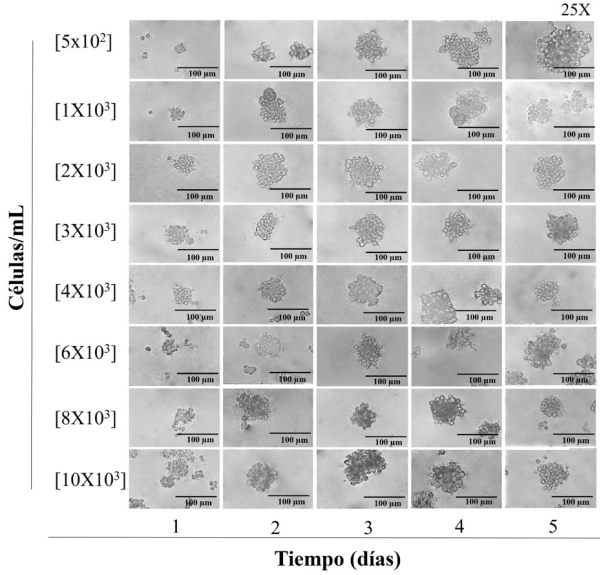
Cada imagen representa esferoides individuales de los experimentos por triplicado.
Fuente: Elaboración de los autores.
El resultado de las mediciones respecto al tamaño de los osteoesferoides mostró que a concentraciones de [5 × 102], [1 × 103], [2 × 103], [3 × 103], [4 × 103], [6 × 103] células/mL hay una mayor homogeneidad en el tamaño de estas estructuras. Mientras que las condiciones de cultivo con concentraciones mayores de [8 × 103], [10 × 103] células/mL muestran esferoides de mayor tamaño rebasando los 170 µm debido a la coagregación celular; por otra parte, en estas dos condiciones también se observan estructuras que no pasan de los 80 µm, observando estructuras que difieren significativamente en forma y tamaño, las cuales se formaron bajo las mismas condiciones de cultivo (Figura 2). Estos datos sugieren que el número de células es determinante para observar la formación de esferoides sin agregados celulares. Para esta línea celular, las concentraciones menores son las indicadas para la formación de osteoesferoides homogéneos durante 5 días.
Figura 2
Determinación del tamaño de los osteoesferoides.
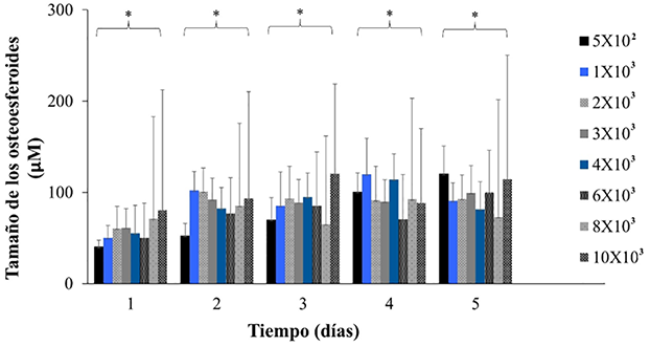
El tamaño de las esferas fue determinado usando el programa ImageJ y tomando el diámetro de estas para el análisis a lo largo del ensayo. Los datos son presentados como la media ± ES (n = 3). Los asteriscos indican las diferencias significativas (*p < 0.05) determinadas por la prueba de ANOVA y con post hoc de Tukey.
Fuente: Elaboración de los autores.
Los ensayos de formación de esferoides se llevaron a cabo a 3, 7, 14 y 21 días con la finalidad de determinar la condición ideal para obtener osteoesferoides para los ensayos de mineralización. Nuestros datos muestran que los osteoesferoides a 3 y 7 son más homogéneos en concentraciones de hasta [4 × 103] células/mL, pero para los días 14 y 21, es claro que el crecimiento de estas estructuras propicia la formación de coagregados incluso a concentraciones de [5 × 102], generando una heterogeneidad mayor respecto al tamaño, así como se observa la disgregación de estas estructuras por saturación del cultivo y se identifican áreas que sugieren centros necróticos presentes en estas estructuras (Figura 3).
Figura 3
Fotomicrografía (10X y 4X) de la formación de esferoides de las líneas celulares hFOB 1.19. (osteoblastos) a diferentes concentraciones celulares durante 3, 7, 14 y 21 días.
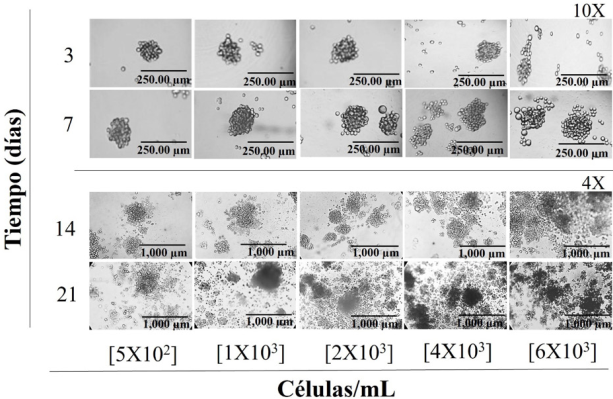
La imagen representa el experimento por triplicado.
Fuente: Elaboración de los autores.
El análisis del tamaño de estos osteoesferoides, indica que a partir del día 7, en concentraciones de [6 × 103] células/mL, presentan mediciones de más de 200 µM y el tamaño de estos, incrementa a los 14 y 21 días de cultivo, alcanzando los 400 µM, incluso desde concentraciones de [1 × 103] células/mL (Figura 4). Los datos sugieren que las concentraciones de [5 × 102] células/mL son más homogéneas; no obstante, a tiempos de 14 y 21 se sugiere la presencia de centros necróticos en estos modelos.
Figura 4
Determinación del tamaño de los osteoesferoides.
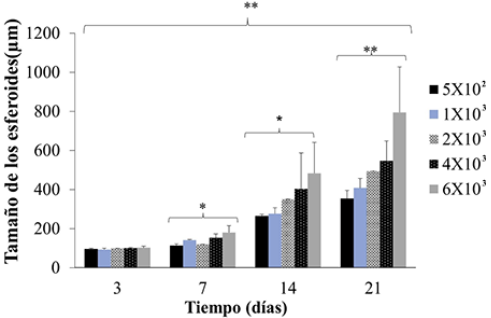
El tamaño de las esferas fue determinado usando el programa ImageJ y tomando el diámetro de estas para el análisis a 3, 7, 14 y 21 días. Los datos son presentados como la media ± ES (n = 3). Los asteriscos indican las diferencias significativas (*p < 0.05 y **p < 0.01) determinadas por la prueba de ANOVA y con post hoc de Tukey.
Fuente: Elaboración de los autores.
Viabilidad celular en los osteoesferoides a 3, 7, 14 y 21 días
La viabilidad celular en los osteoesferoides es indispensable para el uso de estos modelos de estudio en pruebas de nanofármacos y nanomateriales. Los experimentos mostraron que las células disgregadas de los osteoesferoides formados a partir de [5 × 102] células/mL mantiene una viabilidad mayor al 70% hasta a los 7 días de formación; sin embargo, disminuyen su viabilidad a los 14 y 21 días observándose osteoesferoides poco cohesivos, fácil a la disgregación bajo manipulación para la tinción y un área de tinción con azul tripano por arriba del 70% en los remanente de estos a los 21 días de formación, sugiriendo que estos ya no son viables (Figura 5).
Figura 5
Ensayos de viabilidad celular en los osteoesferoides.
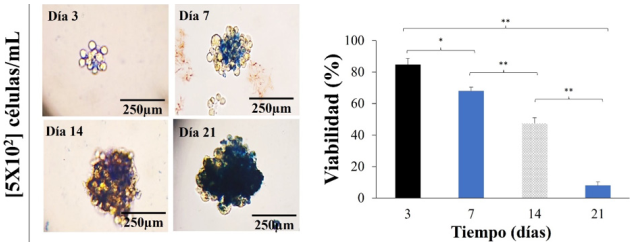
Los ensayos de viabilidad se llevaron a cabo por exclusión de azul tripano a los 3, 7, 14 y 21 días a una concentración celular de [5 x 102]. Las gráficas son presentadas como la media ± ES (n = 3). Los asteriscos indican las diferencias significativas (*p < 0.05 y **p < 0.01) determinadas por la prueba de ANOVA y un post hoc de Tukey.
Fuente: Elaboración de los autores.
Características citológicas de los osteoesferoides 7, 14 y 21 días (H&E)
Al observa que la viabilidad celular de los osteoesferoides disminuía significativamente a partir del día 7 de formación, se obtuvieron tinciones H&E mostrando la disposición celular de estos osteoesferoides. Los resultados presentan células organizadas concéntricamente y subestructuras celulares bien definidas como núcleo y citoplasma. Los osteoesferoides a partir de los 7 días, muestran zonas anucleadas sugiriendo la presencia de zonas necróticas, y a los 21 días se observan claramente tres zonas en los osteoesferoides, un centro menos cohesivo y con mayor número de células anucleadas, una zona intermedia seguida de una delgada capa celular a la periferia, que es la zona de proliferación. Estas características se presentan por la falta de nutrientes y oxígeno que sufren las células localizadas al centro de los esferoides (Figura 6).
Figura 6
Características citológicas de los oesteoesferoides.

Las tinciones H&E de los cortes de los esferoides se llevaron a cabo durante 7, 14 y 21 días a una concentración celular de [5 x 102]. Las imágenes son representativas de tres experimentos realizados de forma individual.
Fuente: Elaboración de los autores.
Efectos del medio que induce mineralización en la formación de osteoesferoides
Los osteoesferoides formados con una concentración de [5 × 102] células/mL, los cuales fueron considerados como clonas, son aquellos con un tamaño ≥ a 50 µm. Los datos mostraron un número disminuido de clonas por campo a los tres días del ensayo; no obstante, a los 7 y 14 días estos cultivos mostraron un incremento significativo en el número de clonas cumpliendo los criterios de tamaño (≥ a 50µm) considerados en estos ensayos. Por otra parte, las clonas no tienen diferencias significativas, tanto en la morfología como en el número de colonias respecto a las que se formaron con el medio mineralizante respecto al control (Figura 7).
Figura 7
Ensayo clonogénico de cultivos en esfera a los 3, 7 y 14 días a una concentración celular de 5 x 102.
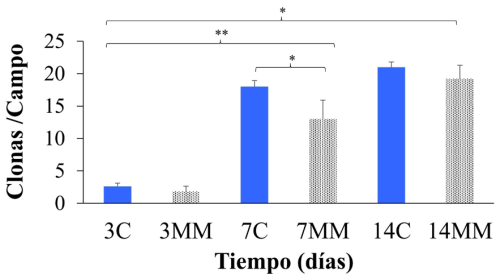
Las gráficas representan la media ± DE de tres experimentos realizados de forma individual. Los asteriscos indican las diferencias significativas (*p < 0.05, ** p < 0.01) determinadas por la prueba de ANOVA y con post hoc de Fisher.
Fuente: Elaboración de los autores.
Formación de nódulos mineralizados por deposición de calcio
En los ensayos para la detección de nódulos mineralizados, observamos un incremento en la formación de estos en los monocapa celulares a lo largo del tiempo. En los osteoesferoides se observa un comportamiento similar a partir de los 7 días, y se identifican zonas con mayor intensidad de tinción con alizarina roja respecto a las monocapas, sugiriendo que los osteoesferoides están formando también nódulos con deposiciones de calcio. Algo interesante de destacar es la presencia de zonas de tinción con alizarina roja en los osteoesferoides incluso en condiciones basales pero que aparecen al día 7 y se observan claramente a los 14 días, sugiriendo que estos osteoesferoides son capaces de formar nódulos mineralizados derivados de la influencia del cultivo tridimensional (Figura 8).
Figura 8
Ensayos de mineralización.
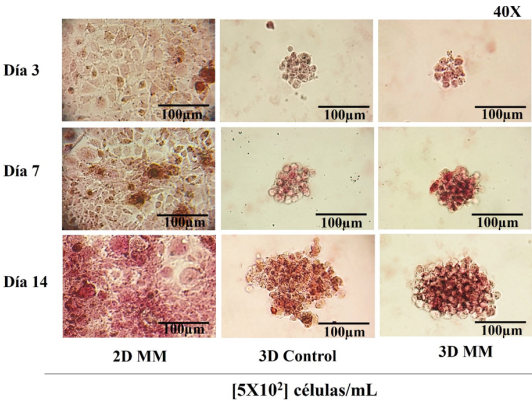
Los ensayos de mineralización se llevaron a cabo por tinción con alizarina roja a los 3, 7 y 14 días a una concentración celular de [5 x 102]. Las imágenes son representativas de experimentos realizados de forma individual.
MM: medio mineralizante; C: control.
Fuente: Elaboración de los autores.
Discusión
Existe un número importante de datos sobre regeneración ósea en modelos bidimensionales, los cuales han contribuido significativamente en el avance de este campo, sin embargo, otros reportes muestran diferencias importantes en el comportamiento de las células en condiciones tridimensionales respecto a los cultivos bidimensionales en diferentes tipos celulares (Soares et al., 2012; Akins et al., 2010; Muguruma et al., 2020; Maliszewska-Olejniczak et al., 2019; Jauković et al., 2020; Sánchez Escamilla, 2021).
La mayoría de las células del cuerpo humano interactúan con células vecinas y con los componentes de la matriz extracelular (ECM) estableciendo una organización 3-D única. Estas interacciones célula-célula y célula-ECM forman una red de comunicación compleja de señales bioquímicas y mecánicas, que son críticas para la fisiología celular normal. Como resultado, la pérdida de propiedades específicas de los tejidos es común para las células cultivadas en cultivos monocapa 2-D (Lin y Chang, 2008). Es importante considerar que la prueba de bioactivos, nanofármacos y nanomateriales se ven influenciadas por la matriz extracelular (Langhans, 2018) y puede modificarse por la presencia de algún andamio, por lo cual la obtención de modelos generados a partir de la clonación promueve la obtención de modelos de investigación sin variables que interfieran en los resultados ante cualquier prueba. Los osteoesferoides obtenidos a concentraciones de [5 × 102] células/mL presentan estas características en los tres primeros días de formación, su formación se dio por crecimiento clonal, permitiendo obtener osteoesferoides más cohesivos sugiriendo que la matriz extracelular está bien establecida por lo cual se podría utilizar esta condición para testar nanofármacos o nuevos nanomateriales, pues también mostraron tener una viabilidad por arriba del 90%. Para casos en los cuales se requiera probar efectos sobre la muerte celular o probar algún material que incremente la viabilidad celular, los ensayos a 14 y 21 días bajo estas condiciones pueden ser considerados. Los osteoesferoides obtenidos a los 21 días muestran centros necróticos y zonas celulares quiescentes y una periferia con células viables, este comportamiento es similar a los de otros investigadores (Lin y Chang, 2008; Cui, Hartanto y Zhang, 2017).
Si bien nuestros datos muestras una disminución en la viabilidad celular a tiempos largos es importante considerar que la tasa de proliferación de la línea HFOb 1.19 es alta, por lo tanto, probar concentraciones por debajo de nuestra propuesta es una opción; por otra parte, una alternativa derivada de los avances recientes en el campo de la ingeniería de tejidos indica que la modulación de la composición celular de los esferoides puede mejorar su capacidad regenerativa. De hecho, la combinación de diferentes tipos de células en esferoides de cocultivo puede imitar mucho mejor las complejas interacciones naturales y heterotípicas de células a células de los tejidos normales que los esferoides de monocultivo. Por lo tanto, la fabricación de esferoides de cocultivo representa un paso clave hacia la generación de sustitutos de tejidos con función fisiológica mejorada (Gionet-Gonzales y Leach, 2018).
Una tarea importante en el desarrollo de modelos tridimensionales es determinar la disposición estructural de estas, los esferoides muestran células con subestructuras como el núcleo y citoplasma los cuales son similares a los datos reportados por otros investigadores (Antoni et al., 2015). A pesar de haber observado estructuras esféricas en el ordenamiento celular que se muestra, es importante determinar la expresión de marcadores asociados con procesos como proliferación, diferenciación y mineralización.
Los ensayos clonogénicos para determinar el efecto de ácido ascórbico y del β-glicerofosfato en la formación de los osteoesferoides mostraron que esta línea celular es sensible al tipo de cultivo en el cual se desarrollan los esferoides, pues el número de clonas obtenidas es menor a lo observado en el cultivo en suspensión. Los resultados no muestran un cambio importante entre el número de clonas del basal respecto a las clonas obtenidas con el medio inductor; asimismo, un dato importante indica cómo influye el medio mineralizante en la forma de estas, generando clonas con formas menos esféricas en el medio mineralizante respecto a las que se crecieron como control, esto refuerza lo observado por otros autores en los que el tipo de cultivo y los suplementos del medio de cultivo modifican la respuesta celular (McKee y Chaudhry, 2017; Cui, Hartanto y Zhang, 2017; Senrung et al., 2023), lo cual debe ser considerado al momento del diseño experimental.
Los datos observados en osteoesferoides bajo condiciones de cultivo en suspensión hasta los 14 días y creciendo con el medio que induce la formación de nódulos mineralizados, sugiere que este cultivo provee las condiciones adecuadas para mejorar la respuesta celular para la formación de nódulos por deposición de calcio incluso en condiciones basales.
Los resultados obtenidos en este trabajo demuestran que los osteoblastos de una línea celular establecida son capaces de formar estructuras tridimensionales que les confieren la capacidad tener un microambiente mucho más parecido al que se tiene en los sistemas biológicos complejos. La capacidad de proliferación de las células en cultivos en suspensión es un factor determinante. Los osteoblastos utilizados en los ensayos celulares mostraron una alta tasa de proliferación por lo cual concentraciones elevadas de células crean estructuras esferoidales grandes por agregación celular y no por crecimiento clonogénico. Se ha reportado que los esferoides formados por agregación celular tienden a presentan uniones más inestables, y que las condiciones idóneas para la formación de esferas es aquella que se da por el crecimiento clonal derivado de la proliferación celular (Maliszewska-Olejniczak et al., 2019; McKee y Chaudhry, 2017).
Los datos obtenidos hasta el momento indican que la estructura tridimensional en la cual se desarrollan los diferentes procesos moleculares en el cuerpo son de suma importancia, pues el nicho celular representa un entorno en el cual se regula estrictamente la respuesta celular ante los embates del medio externo y la estandarización para generar estas condiciones debe estar finamente establecida considerando que estas estructuras serán utilizadas en la regeneración de tejidos.
Conclusión
Las enfermedades óseo degenerativas son un común en la población etaria de la tercera edad. Los avances en la biomedicina en las últimas décadas han contribuido a mejorar la calidad de vida de los pacientes; sin embargo, existen condiciones debido a las cuales los pacientes no responden a la terapia convencional. El auge en los últimos años en el estudio y aplicación de terapias de vanguardia en donde se prueban nanomateriales, nanofármacos y bioactivos para favorecer las propiedades regenerativas de las células en el campo de la regeneración ósea ha dado grandes resultados y promete ampliar las opciones de tratamiento para los pacientes ofreciendo una medicina personalizada, predecible y exitosa. Si bien a la fecha está incrementándose el número de estudios con modelos tridimensionales, no es del todo claro el comportamiento de las células bajo estas condiciones de crecimiento. En este trabajo se establecieron las condiciones del crecimiento de osteoesferas a 3, 7, 14 y 21 días. Los datos indicaron que para ensayos de mineralización las concentraciones celulares son determinantes en el comportamiento biológico a lo largo del tiempo, indicando la importancia de comprender el potencial de proliferación de la línea celular de estudio para utilizar las condiciones idóneas para el fin que se busca. También se observó que las esferas son capaces de formar nódulos de mineralización; asimismo, sería importante observar el comportamiento en la formación de estos al interior de la esfera. Finalmente, al seccionar las osteoesferas encontramos ordenamientos de células mostrando integridad celular, sugiriendo que esta estandarización puede ser utilizada para determinar diferentes procesos biológicos en condiciones tridimensionales.
Referencias
Achilli, Toni-Marie, Julia Meyer y Jeffrey R. Morgan. (2012). Advances in the formation, use and understanding of multi-cellular spheroids. Expert Opinion on Biological Therapy, 12(10): 1347-60. https://doi.org/10.1517/14712598.2012.707181.
Toni-Marie Achilli Julia Meyer Jeffrey R. Morgan 2012Advances in the formation, use and understanding of multi-cellular spheroidsExpert Opinion on Biological Therapy12101347136010.1517/14712598.2012.707181
Akins, Robert E., Danielle Rockwood, Karyn G. Robinson, Daniel Sandusky, John Rabolt y Christian Pizarro. (2010). Three-dimensional culture alters primary cardiac cell phenotype. Tissue Engineering. Part A, 16(2): 629-41. https://doi.org/10.1089/ten.tea.2009.0458.
Robert E. Akins Danielle Rockwood Karyn G. Robinson Daniel Sandusky John Rabolt Christian Pizarro 2010Three-dimensional culture alters primary cardiac cell phenotypeTissue Engineering. Part A16262964110.1089/ten.tea.2009.0458
Antoni, Delphine, Hélène Burckel, Elodie Josset y Georges Noel. (2015). Three-dimensional cell culture: a breakthrough in vivo. International Journal of Molecular Sciences, 16(3): 5517-27. https://doi.org/10.3390/ijms16035517.
Delphine Antoni Hélène Burckel Elodie Josset Georges Noel 2015Three-dimensional cell culture: a breakthrough in vivoInternational Journal of Molecular Sciences1635517552710.3390/ijms16035517
Baptista, Leandra Santos. (2018). Spheroids of stem cells as endochondral templates for improved bone engineering. Frontiers in Bioscience, 23(10): 1969-86. https://doi.org/10.2741/4683.
Leandra Santos Baptista 2018Spheroids of stem cells as endochondral templates for improved bone engineeringFrontiers in Bioscience23101969198610.2741/4683
Berthiaume, François, Timothy J. Maguire y Martin L. Yarmush. (2011). Tissue engineering and regenerative medicine: history, progress, and challenges. Annual Review of Chemical and Biomolecular Engineering, 2(1): 403-30. https://doi.org/10.1146/annurev-chembioeng-061010-114257.
François Berthiaume Timothy J. Maguire Martin L. Yarmush 2011Tissue engineering and regenerative medicine: history, progress, and challengesAnnual Review of Chemical and Biomolecular Engineering2140343010.1146/annurev-chembioeng-061010-114257
Cappariello, Alfredo, Marco Ponzetti y Nadia Rucci. (2016). The ‘soft’ side of the bone: unveiling its endocrine functions. Hormone Molecular Biology and Clinical Investigation, 28(1): 5-20. https://doi.org/10.1515/hmbci-2016-0009.
Alfredo Cappariello Marco Ponzetti Nadia Rucci 2016The ‘soft’ side of the bone: unveiling its endocrine functionsHormone Molecular Biology and Clinical Investigation28152010.1515/hmbci-2016-0009
Cesarz, Zoe y Kenichi Tamama. (2016). Spheroid culture of mesenchymal stem cells. Stem Cells International, (2016): 9176357. https://doi.org/10.1155/2016/9176357.
Zoe Cesarz Kenichi Tamama 2016Spheroid culture of mesenchymal stem cellsStem Cells International2016917635710.1155/2016/9176357
Cui, X., Y. Hartanto y H. Zhang. (2017). Advances in multicellular spheroids formation. Journal of the Royal Society Interface, 14(127): 20160877. https://doi.org/10.1098/rsif.2016.0877.
X. Cui Y. Hartanto H. Zhang 2017Advances in multicellular spheroids formationJournal of the Royal Society Interface141272016087710.1098/rsif.2016.0877
Curcio, Efrem, Simona Salerno, Giuseppe Barbieri, Loredana De Bartolo, Enrico Drioli y Augustinus Bader. (2007). Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials, 28(36): 5487-97. https://doi.org/10.1016/j.biomaterials.2007.08.033.
Efrem Curcio Simona Salerno Giuseppe Barbieri Loredana De Bartolo Enrico Drioli Augustinus Bader 2007Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane systemBiomaterials28365487549710.1016/j.biomaterials.2007.08.033
Edmondson, Rasheena, Jessica Jenkins Broglie, Audrey F. Adcock y Liju Yang. (2014). Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and Drug Development Technologies, 12(4): 207-18. https://doi.org/10.1089/adt.2014.573.
Rasheena Edmondson Jessica Jenkins Broglie Audrey F. Adcock Liju Yang 2014Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensorsAssay and Drug Development Technologies12420721810.1089/adt.2014.573
Fennema, Eelco, Nicolas Rivron, Jeroen Rouwkema, Clemens Van Blitterswijk y Jan De Boer. (2013). Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology, 31(2): 108-15. https://doi.org/10.1016/j.tibtech.2012.12.003.
Eelco Fennema Nicolas Rivron Jeroen Rouwkema Clemens Van Blitterswijk Jan De Boer 2013Spheroid culture as a tool for creating 3D complex tissuesTrends in Biotechnology31210811510.1016/j.tibtech.2012.12.003
Florencio-Silva, Rinaldo, Gisela Rodrigues da Silva Sasso, Estela Sasso-Cerri, Manuel Jesus Simões y Paulo Sérgio Cerri. (2015). Biology of bone tissue: structure, function, and factors that influence bone cells. BioMed Research International, 2015: 421746. https://doi.org/10.1155/2015/421746.
Rinaldo Florencio-Silva Gisela Rodrigues da Silva Sasso Estela Sasso-Cerri Manuel Jesus Simões Paulo Sérgio Cerri 2015Biology of bone tissue: structure, function, and factors that influence bone cellsBioMed Research International201542174610.1155/2015/421746
Gionet-Gonzales, Marissa A. y J. Kent Leach. (2018). Engineering principles for guiding spheroid function in the regeneration of bone, cartilage, and skin. Biomedical Materials. 13(3): 034109. Bristol, England. https://doi.org/10.1088/1748-605X/aab0b3.
Marissa A. Gionet-Gonzales J. Kent Leach 2018Engineering principles for guiding spheroid function in the regeneration of bone, cartilage, and skinBiomedical Materials133034109Bristol, England10.1088/1748-605X/aab0b3
Gurumurthy, Bhuvaneswari, Patrick C. Bierdeman y Amol V. Janorkar. (2017). Spheroid model for functional osteogenic evaluation of human adipose derived stem cells. Journal of Biomedical Materials Research Part A, 105(4): 1230-36. https://doi.org/10.1002/jbm.a.35974.
Bhuvaneswari Gurumurthy Patrick C. Bierdeman Amol V. Janorkar 2017Spheroid model for functional osteogenic evaluation of human adipose derived stem cellsJournal of Biomedical Materials Research Part A10541230123610.1002/jbm.a.35974
Hart, Nicolas H., Robert U. Newton, Jocelyn Tan, Timo Rantalainen, Paola Chivers, Aris Siafarikas y Sophia Nimphius. (2020). Biological basis of bone strength: anatomy, physiology and measurement. Journal of Musculoskeletal & Neuronal Interactions, 20(3): 347-71.
Nicolas H. Hart Robert U. Newton Jocelyn Tan Timo Rantalainen Paola Chivers Aris Siafarikas Sophia Nimphius 2020Biological basis of bone strength: anatomy, physiology and measurementJournal of Musculoskeletal & Neuronal Interactions203347371
Henry, James P. y Bruno Bordoni. (2024). Histology, osteoblasts. StatPearls. Treasure Island (FL): StatPearls Publishing. http://www.ncbi.nlm.nih.gov/books/NBK557792/.
James P. Henry Bruno Bordoni 2024Histology, osteoblastsStatPearls. Treasure Island (FL)StatPearls Publishinghttp://www.ncbi.nlm.nih.gov/books/NBK557792/
Hu, Guoqing y Dongqing Li. (2007). Three-dimensional modeling of transport of nutrients for multicellular tumor spheroid culture in a microchannel. Biomedical Microdevices, 9(3): 315-23. https://doi.org/10.1007/s10544-006-9035-1.
Guoqing Hu Dongqing Li 2007Three-dimensional modeling of transport of nutrients for multicellular tumor spheroid culture in a microchannelBiomedical Microdevices9331532310.1007/s10544-006-9035-1
Jauković, Aleksandra, Desislava Abadjieva, Drenka Trivanović, Elena Stoyanova, Milena Kostadinova, Shina Pashova, Snejana Kestendjieva et al. (2020). Specificity of 3D MSC spheroids microenvironment: impact on MSC behavior and properties. Stem Cell Reviews and Reports, 16(5): 853-75. https://doi.org/10.1007/s12015-020-10006-9.
Aleksandra Jauković Desislava Abadjieva Drenka Trivanović Elena Stoyanova Milena Kostadinova Shina Pashova Snejana Kestendjieva 2020Specificity of 3D MSC spheroids microenvironment: impact on MSC behavior and propertiesStem Cell Reviews and Reports16585387510.1007/s12015-020-10006-9
Kapałczyńska, Marta, Tomasz Kolenda, Weronika Przybyła, Maria Zajączkowska, Anna Teresiak, Violetta Filas, Matthew Ibbs, Renata Bliźniak, Łukasz Łuczewski y Katarzyna Lamperska. (2018). 2D and 3D cell cultures - A comparison of different types of cancer cell cultures. Archives of Medical Science: AMS, 14(4): 910-19. https://doi.org/10.5114/aoms.2016.63743.
Marta Kapałczyńska Tomasz Kolenda Weronika Przybyła Maria Zajączkowska Anna Teresiak Violetta Filas Matthew Ibbs Renata Bliźniak Łukasz Łuczewski Katarzyna Lamperska 20182D and 3D cell cultures - A comparison of different types of cancer cell culturesArchives of Medical Science: AMS14491091910.5114/aoms.2016.63743
Katsimbri, P. (2017). The biology of normal bone remodelling. European Journal of Cancer Care, 26(6): e12740. https://doi.org/10.1111/ecc.12740.
P. Katsimbri 2017The biology of normal bone remodellingEuropean Journal of Cancer Care266e1274010.1111/ecc.12740
Langdon, Simon P. (2003). Basic principles of cancer cell culture. En Simon P. Langdon, Cancer cell culture, 88: 3-16. New Jersey: Humana Press. https://doi.org/10.1385/1-59259-406-9:3.
Simon P. Langdon 2003Basic principles of cancer cell culture Simon P. Langdon Cancer cell culture88316New JerseyHumana Press10.1385/1-59259-406-9:3
Langhans, Sigrid A. (2018). Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology, 9(enero): 6. https://doi.org/10.3389/fphar.2018.00006.
Sigrid A. Langhans 012018Three-dimensional in vitro cell culture models in drug discovery and drug repositioningFrontiers in Pharmacology9enero610.3389/fphar.2018.00006
Laschke, Matthias W. y Michael D. Menger. (2017). Life is 3D: boosting spheroid function for tissue engineering. Trends in Biotechnology, 35(2): 133-44. https://doi.org/10.1016/j.tibtech.2016.08.004.
Matthias W. Laschke Michael D. Menger 2017Life is 3D: boosting spheroid function for tissue engineeringTrends in Biotechnology35213314410.1016/j.tibtech.2016.08.004
Lin, Ruei‐Zhen y Hwan‐You Chang. (2008). Recent advances in three‐dimensional multicellular spheroid culture for biomedical research. Biotechnology Journal, 3(9-10): 1172-84. https://doi.org/10.1002/biot.200700228.
Ruei‐Zhen Lin Hwan‐You Chang 2008Recent advances in three‐dimensional multicellular spheroid culture for biomedical researchBiotechnology Journal39-101172118410.1002/biot.200700228
Maliszewska-Olejniczak, Kamila, Klaudia K. Brodaczewska, Zofia F. Bielecka, Wojciech Solarek, Anna Kornakiewicz, Cezary Szczylik, Camillo Porta y Anna M. Czarnecka. (2019). Development of extracellular matrix supported 3D culture of renal cancer cells and renal cancer stem cells. Cytotechnology, 71(1): 149-63. https://doi.org/10.1007/s10616-018-0273-x.
Kamila Maliszewska-Olejniczak Klaudia K. Brodaczewska Zofia F. Bielecka Wojciech Solarek Anna Kornakiewicz Cezary Szczylik Camillo Porta Anna M. Czarnecka 2019Development of extracellular matrix supported 3D culture of renal cancer cells and renal cancer stem cellsCytotechnology71114916310.1007/s10616-018-0273-x
McKee, Christina y G. Rasul Chaudhry. (2017). Advances and challenges in stem cell culture. Colloids and Surfaces B: Biointerfaces, 159(noviembre): 62-77. https://doi.org/10.1016/j.colsurfb.2017.07.051.
Christina McKee G. Rasul Chaudhry 112017Advances and challenges in stem cell cultureColloids and Surfaces B: Biointerfaces159noviembre627710.1016/j.colsurfb.2017.07.051
Muguruma, Masako, Saeko Teraoka, Kana Miyahara, Ai Ueda, Mariko Asaoka, Miki Okazaki, Takahiko Kawate, Masahiko Kuroda, Yohei Miyagi y Takashi Ishikawa. (2020). Differences in drug sensitivity between two-dimensional and three-dimensional culture systems in triple-negative breast cancer cell lines. Biochemical and Biophysical Research Communications, 533(3): 268-74. https://doi.org/10.1016/j.bbrc.2020.08.075.
Masako Muguruma Saeko Teraoka Kana Miyahara Ai Ueda Mariko Asaoka Miki Okazaki Takahiko Kawate Masahiko Kuroda Yohei Miyagi Takashi Ishikawa 2020Differences in drug sensitivity between two-dimensional and three-dimensional culture systems in triple-negative breast cancer cell linesBiochemical and Biophysical Research Communications533326827410.1016/j.bbrc.2020.08.075
Ponzetti, Marco y Nadia Rucci. (2021). Osteoblast differentiation and signaling: established concepts and emerging topics. International Journal of Molecular Sciences, 22(13): 6651. https://doi.org/10.3390/ijms22136651.
Marco Ponzetti Nadia Rucci 2021Osteoblast differentiation and signaling: established concepts and emerging topicsInternational Journal of Molecular Sciences2213665110.3390/ijms22136651
Poornima, Kolluri, Arul Prakash Francis, Muddasarul Hoda, Mohamed Ahmed Eladl, Srividya Subramanian, Vishnu Priya Veeraraghavan, Mohamed El-Sherbiny et al. (2022). Implications of three-dimensional cell culture in cancer therapeutic research. Frontiers in Oncology, 12(mayo): 891673. https://doi.org/10.3389/fonc.2022.891673.
Kolluri Poornima Arul Prakash Francis Muddasarul Hoda Mohamed Ahmed Eladl Srividya Subramanian Vishnu Priya Veeraraghavan Mohamed El-Sherbiny 052022Implications of three-dimensional cell culture in cancer therapeutic researchFrontiers in Oncology12mayo89167310.3389/fonc.2022.891673
Roi, Alexandra, Lavinia Cosmina Ardelean, Ciprian Ioan Roi, Eugen-Radu Boia, Simina Boia y Laura-Cristina Rusu. (2019). Oral bone tissue engineering: advanced biomaterials for cell adhesion, proliferation and differentiation. Materials, 12(14): 2296. https://doi.org/10.3390/ma12142296.
Alexandra Roi Lavinia Cosmina Ardelean Ciprian Ioan Roi Eugen-Radu Boia Simina Boia Laura-Cristina Rusu 2019Oral bone tissue engineering: advanced biomaterials for cell adhesion, proliferation and differentiationMaterials1214229610.3390/ma12142296
Rosenberg, Nahum, Orit Rosenberg y Michael Soudry. (2012). Osteoblasts in bone physiology - Mini review. Rambam Maimonides Medical Journal, 3(2): e0013. https://doi.org/10.5041/RMMJ.10080.
Nahum Rosenberg Orit Rosenberg Michael Soudry 2012Osteoblasts in bone physiology - Mini reviewRambam Maimonides Medical Journal32e001310.5041/RMMJ.10080
Ryu, Na-Eun, Soo-Hong Lee y Hansoo Park. (2019). Spheroid culture system methods and applications for mesenchymal stem cells. Cells, 8(12): 1620. https://doi.org/10.3390/cells8121620.
Na-Eun Ryu Soo-Hong Lee Hansoo Park 2019Spheroid culture system methods and applications for mesenchymal stem cellsCells812162010.3390/cells8121620
Sánchez Escamilla, José Luis. (2021). Esferoides: unidades biológicas para la regeneración ósea. Tesis para obtener el título de cirujano dentista. Facultad de Odontología, Universidad Nacional Autónoma de México.
José Luis Sánchez Escamilla 2021Esferoides: unidades biológicas para la regeneración óseacirujano dentistaFacultad de Odontología, Universidad Nacional Autónoma de México
Seeman, Ego y Pierre D. Delmas. (2006). Bone quality - The material and structural basis of bone strength and fragility. New England Journal of Medicine, 354(21): 2250-61. https://doi.org/10.1056/NEJMra053077.
Ego Seeman Pierre D. Delmas 2006Bone quality - The material and structural basis of bone strength and fragilityNew England Journal of Medicine354212250226110.1056/NEJMra053077
Senrung, Anna, Sakshi Lalwani, Divya Janjua, Tanya Tripathi, Jasleen Kaur, Netra Ghuratia, Nikita Aggarwal et al. (2023). 3D tumor spheroids: morphological alterations a yardstick to anti-cancer drug response. In vitro Models, 2(6): 219-48. https://doi.org/10.1007/s44164-023-00059-8.
Anna Senrung Sakshi Lalwani Divya Janjua Tanya Tripathi Jasleen Kaur Netra Ghuratia Nikita Aggarwal 20233D tumor spheroids: morphological alterations a yardstick to anti-cancer drug responseIn vitro Models2621924810.1007/s44164-023-00059-8
Soares, Carolina Pontes, Victor Midlej, Maria Eduarda Weschollek de Oliveira, Marlene Benchimol, Manoel Luis Costa y Cláudia Mermelstein. (2012). 2D and 3D-organized cardiac cells shows differences in cellular morphology, adhesion junctions, presence of myofibrils and protein expression. PLoS ONE, 7(5): e38147. https://doi.org/10.1371/journal.pone.0038147.
Carolina Pontes Soares Victor Midlej Maria Eduarda Weschollek de Oliveira Marlene Benchimol Manoel Luis Costa Cláudia Mermelstein 20122D and 3D-organized cardiac cells shows differences in cellular morphology, adhesion junctions, presence of myofibrils and protein expressionPLoS ONE75e3814710.1371/journal.pone.0038147
Whitesides, George M. y Bartosz Grzybowski. (2002). Self-assembly at all scales. Science, 295(5564): 2418-21. https://doi.org/10.1126/science.1070821.
George M. Whitesides Bartosz Grzybowski 2002Self-assembly at all scalesScience29555642418242110.1126/science.1070821