Introducción
Las nanopartículas son partículas de tamaños comprendidos entre 1 y 100 nm (Bayda et al., 2019). Debido a sus tamaños y propiedades únicas, las nanopartículas han atraído gran atención en diversos campos del conocimiento, como la medicina (Kučuk et al., 2023; Geetha, Yekkala, y Kiran, 2024), la electrónica (Mo et al., 2019), y las ciencias medioambientales (Koul et al., 2021). Al reducir su tamaño, las nanopartículas pueden tener una mayor relación superficie/volumen, lo cual permite un mayor número de átomos o moléculas por volumen, significando lo anterior que se necesita menos cantidad del material para obtener las mismas propiedades que su contraparte macroscópica y presentar otras (Navya y Daima, 2016).
Las nanopartículas pueden clasificarse en función de su composición, forma y tamaño. Los tipos más comunes de nanopartículas son las metálicas, las de óxidos metálicos, las basadas en carbono, las poliméricas y los puntos cuánticos. Existen muchos métodos físicos, químicos y biológicos para sintetizarlas (Ijaz et al., 2020), dentro de los métodos químicos y biológicos, la química verde está ganando relevancia (Vijayaram et al., 2024).
La síntesis por química verde está recibiendo atención en los últimos años. Las fuentes naturales, como los extractos de plantas o los microrganismos, son los recursos más utilizados para desarrollar esta síntesis (Ijaz et al., 2020). Este método tiene varias ventajas sobre los procedimientos de síntesis tradicionales, como el bajo costo, la escalabilidad y la reducción de producción de residuos peligrosos. Además, la síntesis por química verde puede producir nanopartículas con formas, tamaños y propiedades superficiales únicas, adaptadas a aplicaciones específicas (Gupta et al. 2023).
Las fuentes biológicas utilizadas para la síntesis de nanopartículas contienen compuestos biológicamente activos, como enzimas, proteínas, polifenoles, flavonoides, entre otros, los cuales actúan como agentes catalizadores, reductores, estabilizadores para la síntesis en un solo paso (Gupta et al., 2023; Majumdar et al., 2020).
Dentro de las propiedades de las nanopartículas está su capacidad antibacteriana, lo cual ha contribuido a ser estas objeto de amplias investigaciones, especialmente en el entorno del aumento de la resistencia a los antibióticos por parte de las bacterias. Estas propiedades se pueden atribuir a varios factores, entre ellos su elevada relación superficie/volumen, la cual mejora su interacción con los organismos diana. Esta característica única permite a las nanopartículas actuar como agentes antibacterianos y superar las resistencias desarrolladas contra los antibióticos convencionales (Moradi et al., 2023).
En este artículo se presenta una visión general de empleo de la química verde para sintetizar nanopartículas, los recursos biológicos disponibles para desarrollar esta técnica, los factores y mecanismos implicados en su producción, así como su aplicación antibacteriana demostrada.
Nanopartículas
Las nanopartículas pertenecen a la nanociencia encargada del estudio de los fenómenos y el manejo de materiales a escala nanométrica, definida en el intervalo de 1 a 100 nm (Bayda et al., 2019). Reducir el tamaño permite sintetizar estructuras con mayor relación superficie/volumen, es decir, hay mayor cantidad de átomos o moléculas por unidad de volumen (Figura 1), e involucra a la nanotecnología enfocada en el diseño, la caracterización y la aplicación de estructuras, dispositivos y sistemas complejos mediante el control de la forma, el tamaño y las propiedades de la materia a esta escala (Zhang y Webster, 2009).
Figura 1
Relación superficie/volumen de un nanomaterial comparado con materiales macroscópicos.
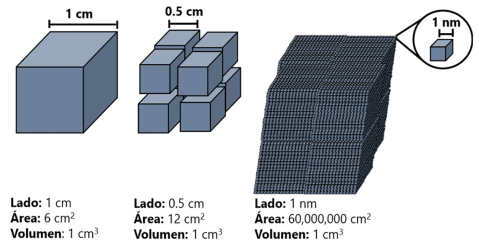
Fuente: Elaboración de los autores.
La importancia de las nanopartículas radica en que en el mundo nanométrico, los materiales pueden adquirir o realzar propiedades (biológicas, mecánicas, eléctricas, magnéticas, ópticas, catalíticas, entre otras) diferentes a las que tienen sus homólogos macroscópicos (Moradi et al., 2023), por lo cual se considera que al disminuir el tamaño se obtiene un nuevo material, además de que la diversidad de formas, composición y propiedades físicas permiten el desarrollo de aplicaciones en campos tan diversos como el médico, tecnológico, electrónico, informático, alimenticio, textil, por mencionar algunos, siendo, en consecuencia, objeto de intensa investigación científica (Ijaz et al., 2020; Anees et al., 2024).
Debido a lo anterior, se está en búsqueda de metodologías para sintetizarlas con el menor impacto posible al ambiente, siendo la química verde una de las tecnologías que se están desarrollando y aplicando para llevar a cabo este procedimiento.
Generalidades de la química verde
La química verde tiene como objetivo promover tecnologías químicas innovadoras para reducir o eliminar el uso y la producción de sustancias peligrosas en el diseño, fabricación y empleo de productos químicos. Consiste en reducir al mínimo o de ser posible eliminar por completo la contaminación producida en procesos de elaboración, evitando al máximo el consumo y desperdicio de materias primas no renovables, así como el empleo de materiales peligrosos o contaminantes en la fabricación de productos (Anastas, 1998).
Paul J. Anastas, considerado el padre de la química verde, la define como “una filosofía de trabajo, la cual implica la utilización de herramientas y caminos alternativos que prevengan la contaminación”, refiriéndose tanto al diseño de la estrategia sintética como al tratamiento de los posibles productos secundarios que se produzcan de dicha ruta (Anastas, 1998; Hebbalalu et al., 2013).
Para considerar si un proceso, ya sea de síntesis, manufactura, industrial, etc., es de química verde se deben cumplir los 12 principios de la química verde (Anastas, 1998):
-
Evitar la generación de residuos o tratarlos una vez formados.
-
La ruta sintética debe diseñarse para maximizar la incorporación de la materia prima usada en el producto final.
-
La metodología sintética debe procurar generar un mínimo de sustancias tóxicas para el ser humano y el ambiente.
-
Los productos químicos diseñados deben ser eficaces e inocuos.
-
Se deben usar sustancias auxiliares (disolventes) seguras o evitarlas en lo posible.
-
Los requerimientos energéticos de la ruta sintética deben ser tomados en cuenta y minimizados. Las reacciones deben llevarse a cabo a temperatura ambiente y presión atmosférica normal cuando sea factible.
-
Las materias primas deben ser renovables cuando sea técnica y económicamente favorable.
-
Reducir la formación de subproductos.
-
Usar catalizadores en las reacciones.
-
Los productos químicos deben diseñarse para que al final de su vida útil se descompongan en compuestos inocuos.
-
La metodología analítica debe ser usada para poder controlar los procesos, evitando la formación de sustancias peligrosas.
-
Las sustancias y su estado físico deben elegirse con cuidado para evitar posibles situaciones de riesgo como explosiones o fuegos.
Síntesis de nanopartículas por química verde
Para generar nanopartículas se distinguen dos enfoques, el de “arriba-abajo”, en el cual se producen las nanopartículas mediante técnicas físicas como la molienda o la abrasión de un material y el enfoque de “abajo-arriba” donde las nanopartículas se generan a partir de “nanobloques” de átomos o moléculas, dando lugar a agrupaciones más complejas (Figura 2) (Singh et al., 2018).
Figura 2
Fases involucradas en la síntesis de nanopartículas por química verde.
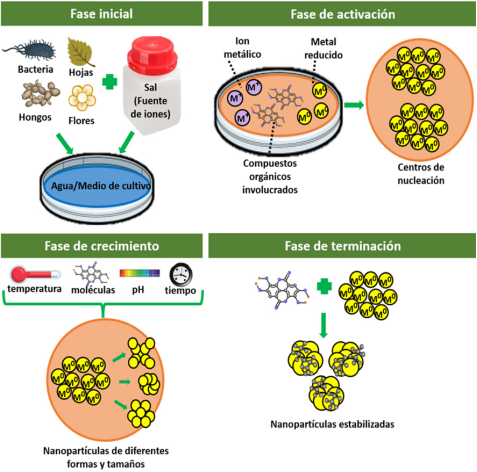
Fuente: Elaboración de los autores.
En el enfoque “abajo-arriba” se encuentra la síntesis química: método general para producir moléculas o partículas mediante la reacción entre las sustancias usadas como materia prima, el autoensamble en la cual los átomos o moléculas se ordenan a sí mismos mediante interacciones físicas y/o químicas, y el ensamble posicional donde los átomos, moléculas o sus agregados son manipulados deliberadamente y posicionados uno por uno.
Las metodologías “abajo-arriba” se prefieren sobre las “arriba-abajo” por no requerirse equipo especializado y los tiempos para obtener las nanopartículas son menores (Kumar, Bhushan y Bhattacharya, 2018).
La síntesis por química verde se engloba dentro del enfoque “abajo-arriba”. El uso de plantas, algas o microrganismos, como bacterias u hongos son de los recursos más utilizados para llevar a cabo este procedimiento, porque se cumple adecuadamente con los 12 principios de la química verde.
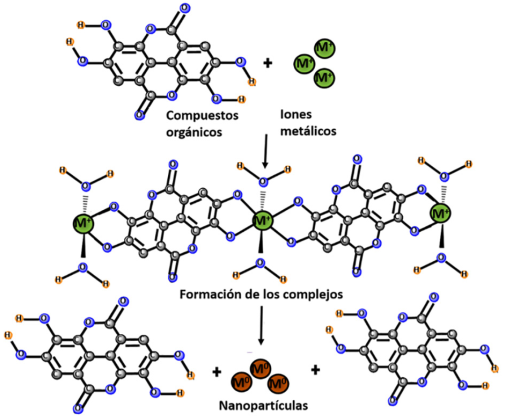
En general, el mecanismo de síntesis por química verde incluye cuatro fases (Figura 2). La fase inicial consiste en la obtención del medio de reacción, que es el extracto, generalmente acuoso, de una o varias partes de la especie vegetal, o el medio de cultivo de los microrganismos y su crecimiento, además de la adición de la sal precursora que será la fuente de los iones metálicos. La segunda fase es la de activación en donde ocurren la reducción química de iones metálicos y la generación de los centros de nucleación donde surgen y crecen las nanopartículas. La tercera fase es la de crecimiento donde las pequeñas nanopartículas adyacentes se fusionan espontáneamente en partículas de mayor tamaño formando agregados, esta fase se ve influenciada por factores como la temperatura, concentración y tipo de compuestos, pH, tiempo de la reacción, etc. Finalmente, la fase de terminación donde se determina la forma final de las nanopartículas y los compuestos que participaron en la reacción ayudan a estabilizarlas y a potenciar sus propiedades (Makarov et al., 2014).
Varios compuestos de las plantas o microrganismos, incluyendo terpenos, polifenoles, alcaloides, carbohidratos, proteínas, material genético, etc., juegan un papel importante en la síntesis de nanopartículas actuando de manera conjunta (Makarov et al., 2014).
Recursos biológicos usados para la síntesis por química verde de nanopartículas
Como se mencionó, las bacterias, los hongos, las algas y las especies vegetales son los recursos biológicos más utilizados para la síntesis por química verde de nanopartículas (Figura 3). Este enfoque biológico ha proporcionado un método confiable, sencillo, rápido y amigable con el ambiente (Koul et al., 2021; Nasrollahzadeh et al., 2019).
Figura 3
Los diferentes enfoques y técnicas utilizados para la síntesis de nanopartículas.
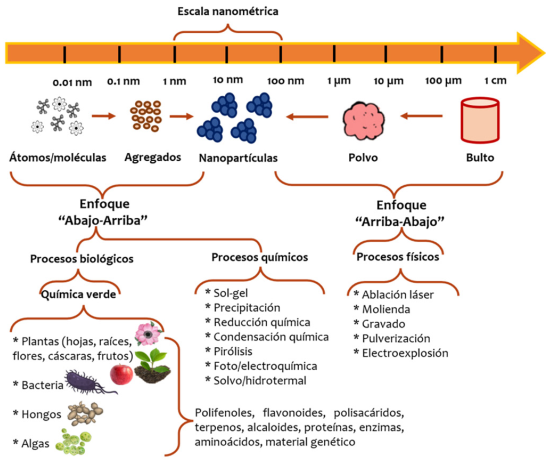
Fuente: Elaboración de los autores.
Bacterias
La síntesis de nanopartículas mediada por bacterias se lleva a cabo de dos maneras: extracelular e intracelular (Singh et al., 2020). Intracelularmente, la síntesis se realiza dentro del microrganismo vivo, usando sus condiciones de crecimiento para favorecer la síntesis. La sal precursora se agrega al medio a una concentración no tóxica para la bacteria. En la biosíntesis influye la especie bacteriana, la temperatura, el pH y el tipo de extracto (sobrenadante o intracelular) (Solís-Sandí et al., 2023).
Para la síntesis extracelular se usan los componentes liberados por las bacterias cuando se lisan. La síntesis se realiza agregando la sal precursora al medio donde están esos componentes. La síntesis extracelular tiene la ventaja de ser más rápida al no requerir más pasos para recuperar las nanopartículas del microrganismo (Deljou y Goudarzi, 2016).
Entre los componentes participando en la síntesis están las enzimas como las reductasas, que aceleran (catalizan) la reducción de iones metálicos en nanopartículas metálicas. Inclusive, componentes de su material genético también participan en este proceso (Singh et al., 2016; Messaoudi y Bendahou, 2020).
Hongos y levaduras
Los hongos contienen biomoléculas activas como proteínas o enzimas, que participan en la síntesis de nanopartículas mejorando sus rendimientos y estabilidad (Vetchinkina et al., 2018; Mukherjee et al., 2001). Algunas especies de hongos pueden sintetizar nanopartículas utilizando aminoácidos extracelulares, por ejemplo, el ácido glutámico y el ácido aspártico en la superficie de la levadura, o la enzima reductasa en el citosol de los hongos, reducen iones metálicos para formar nanopartículas, esto favorecido por la presencia de grupos hidroxilo en el micelio, los cuales donan electrones al ion metálico y lo reducen hasta formar nanopartículas. Las aminas alifáticas y aromáticas, o algunas proteínas actúan como agentes de recubrimiento para estabilizarlas (Syed y Ahmad, 2012; Riddin, Gericke, y Whiteley, 2006).
Algas
Las algas se utilizan en el campo de la nanotecnología debido a su baja toxicidad y a su capacidad de bioacumulación y reducción de metales (Rana, Yadav y Jagadevan, 2020); pueden absorber iones metálicos del medio ambiente; los cuales son luego reducidos a su forma elemental o a un estado de oxidación inferior dentro de las células.
La síntesis de nanopartículas puede ser intracelular, tras el ingreso del ion metálico al cuerpo del alga o extracelular, y participan compuestos como polisacáridos, proteínas y pigmentos dirigiendo la reducción de los iones metálicos y recubriendo las nanopartículas recién formadas, para, posteriormente, ser liberadas de la célula en forma de coloides (Dahoumane et al., 2014).
Plantas
La síntesis mediada por plantas es de las más utilizadas debido a que se evita la manipulación de microrganismos y el uso de medios de cultivo específicos, además de ser de las más rápidas y económicas, porque se involucran menos pasos en el proceso (Hebbalalu et al., 2013; Makarov et al., 2014). Lo cual la hace altamente eficiente en el proceso de obtención de nanopartículas en comparación con la síntesis usando microrganismos.
Las plantas contienen varios compuestos (terpenos, flavonoides, polifenoles, alcaloides, proteínas, etc.) los cuales participan en la reducción de las sales metálicas y en la estabilización de las nanopartículas resultantes (Carrillo-López et al., 2016).
Este tipo de síntesis se puede realizar por métodos intracelulares, extracelulares y el mediado por fitoquímicos (Dauthal y Mukhopadhyay, 2016). La síntesis intracelular se realiza dentro de la célula vegetal y las nanopartículas se recuperan rompiendo esa estructura, muy similar el método intracelular usando microrganismos. Se necesita mucho control de los factores de crecimiento de la especie vegetal para que no intervengan en la síntesis (Saim, Kumah y Oppong, 2021).
La síntesis extracelular es de las más usadas por su facilidad y rapidez, se comienza obteniendo un extracto de la planta, generalmente a base de agua, en donde se agrega la sal precursora y por acción de los diferentes compuestos presentes en el extracto, se generan y estabilizan las nanopartículas en prácticamente un solo paso (Saim, Kumah y Oppong, 2021; Naikoo et al., 2021).
La mediada por fitoquímicos se basa en el método extracelular, pero con la diferencia de que se trabaja con los compuestos fitoquímicos aislados y se añaden otras sustancias estabilizadoras de las nanopartículas, hay un mayor control de la síntesis, pero se involucran más componentes y pasos (Dauthal y Mukhopadhyay, 2016).
Otros factores que participan en la síntesis
Como en todo proceso de síntesis, las condiciones de reacción, como la concentración del ion metálico, la temperatura, el pH, el tiempo de reacción, entre otras, juegan un papel importante en la forma, tamaño y cantidad de las nanopartículas sintetizadas (Agarwal, Venkat Kumar y Rajeshkumar, 2017; Makarov et al., 2014).
La concentración del ion metálico tiene un papel crucial en la síntesis de nanopartículas, afectando la eficiencia, el rendimiento, entre otros de los aspectos del proceso y las características finales de las nanopartículas producidas (Kazemi et al. 2023). Generalmente, a mayor concentración de iones metálicos, mayor es el tamaño de las nanopartículas resultantes. Esto se debe a que una mayor cantidad de iones disponibles puede conducir a un crecimiento más rápido y a una mayor agregación de nanopartículas. También influye en la uniformidad y la distribución del tamaño de las nanopartículas. Concentraciones óptimas pueden llevar a una distribución de tamaño más uniforme, mientras que concentraciones demasiado altas o bajas pueden resultar en una amplia dispersión en los tamaños (Kim et al. 2016). Diferentes concentraciones también pueden favorecer la formación de diversas morfologías, como esferas, prismas, triángulos, entre otras. Concentraciones altas pueden acelerar la formación de nanopartículas, aunque esto también puede llevar a una mayor tendencia a la aglomeración y sedimentación, una concentración muy baja puede no ser suficiente para mantener la estabilidad de las nanopartículas a lo largo del tiempo (Dada et al. 2018).
La temperatura es uno de los factores más influyentes, porque las distintas formas (esféricas, prismáticas, hojuelas, triangulares, octaédricas, entre otras), el tamaño y la síntesis dependen de la temperatura (Álvarez-Chimal et al., 2022). A medida que se incremente la temperatura, aumenta la velocidad de reacción y la formación de centros de nucleación, lo cual genera mayores rendimientos (Stavinskaya et al., 2019). Las distintas temperaturas van a propiciar diferentes interacciones entre los reactivos, dando lugar a formas variadas, y entre más se incremente la temperatura, el tamaño de las nanopartículas tienden a aumentar (Thanh, Maclean y Mahiddine, 2014).
El pH influye en los centros de nucleación, a mayor pH se generan más de estos centros (Thanh, Maclean y Mahiddine, 2014). Otra influencia importante del pH es que algunas nanopartículas se van a sintetizar solo si se encuentran en el medio ácido o básico que requieren. Por ejemplo, nanopartículas magnéticas se sintetizan en pH básicos y nanopartículas de óxidos metálicos en medios generalmente ácidos o neutros (Handayani, Ningrum e Imawan, 2020).
El tiempo de reacción tiene un papel importante para definir el tamaño de las nanopartículas, se ha observado una tendencia de que a mayores tiempos de reacción, se favorece un incremente del tamaño de las nanopartículas, influyendo de igual manera en mayores rendimientos por el tiempo más prolongado de interacción entre los reactivos (Eaimsumang et al., 2019).
Mecanismos involucrados en la síntesis de nanopartículas por química verde
El extracto vegetal u organismo utilizado para la síntesis es un factor importante con influencia en la morfología y el tamaño de las nanopartículas, pues diferentes concentraciones de metabolitos o componentes celulares dan lugar a diferencias en las nanopartículas sintetizadas (Kuppusamy et al., 2016; Álvarez-Chimal et al., 2021; Hebbalalu et al., 2013) (Figura 4).
Figura 4
Nanopartículas sintetizadas por química verde.

a) Nanopartículas de ZnO sintetizadas con la especie vegetal Dysphania ambrosioides a 600 °C; b) nanopartículas de ZnO sintetizadas con la especie vegetal Dysphania ambrosioides a 100 °C; c) nanopartículas de Fe2O3 sintetizadas con la especie vegetal Datura inoxia a temperatura ambiente, y, d) nanopartículas de Fe2O3 sintetizadas con la especie vegetal Datura inoxia a 60 °C.
Fuente: Elaboración de los autores.
Los flavonoides son un amplio grupo de compuestos polifenólicos que pueden quelar y reducir activamente los iones metálicos en nanopartículas, pues contienen varios grupos funcionales capaces de formar estas estructuras. Las transformaciones estructurales de los flavonoides también generan protones que reducen los iones metálicos para formar nanopartículas, por lo cual están implicados en la nucleación, la etapa inicial de su formación y la posterior agregación (Thanh, Maclean, y Mahiddine 2014).
Los iones metálicos forman compuestos de coordinación con los polifenoles, donde la unidad estructural fundamental es el ion metálico central rodeado de los grupos coordinados. Los grupos hidroxilo aromáticos presentes en los polifenoles se unen al ion metálico y forman un complejo coordinado estable. Este sistema sufre una descomposición directa a altas temperaturas, lo cual conduce a la liberación de las nanopartículas del sistema complejo (Nava et al., 2017).
Los flavonoides, aminoácidos, proteínas, terpenoides, taninos, azúcares reductores, etc., tienen la característica de poseer grupos hidroxilo los cuales, al perder electrones, rodean al ion metálico, formando el complejo (Ghasemi et al., 2024). Tras este proceso, los grupos hidroxilo se oxidan a grupos carbonilo, interviniendo en la estabilización de las nanopartículas (Carrillo-López et al., 2016).
Los azúcares también pueden inducir la formación de nanopartículas. Los monosacáridos como la glucosa pueden actuar como agentes reductores, pues el grupo aldehído del azúcar se oxida a un grupo carboxilo mediante la adición de grupos hidroxilo, y, a su vez, conduce a la reducción de los iones metálicos y a la síntesis de nanopartículas (Makarov et al., 2014).
Las proteínas y las enzimas facilitan la formación de nanopartículas a partir de iones metálicos debido a su elevada actividad reductora y a su potencial para atraer iones metálicos a los centros de nucleación. Los aminoácidos de una proteína pueden influir enormemente en el tamaño, la morfología y la cantidad de nanopartículas generadas, desempeñando así un papel muy importante en la determinación de su forma y rendimiento. Dependiendo del tipo de aminoácidos presentes en el extracto y su concentración, junto con las condiciones de reacción, dan lugar a nanopartículas con diferentes morfologías. La eliminación de un protón del grupo hidroxilo de los aminoácidos da lugar a la formación de estructuras resonantes capaces de oxidarse posteriormente. Este proceso va acompañado de la reducción activa de iones metálicos, seguida de la formación de nanopartículas (Figura 5) (Nava et al., 2017).
Aplicación antibacteriana de las nanopartículas
En los últimos años, el número de infecciones asociadas con bacterias resistentes a los antibióticos han aumentado. Los antibióticos actúan inhibiendo las síntesis de pared celular, proteínas y ácidos nucleicos, o alterando funciones de la membrana celular y el metabolismo bacteriano (Darby et al., 2023). Las bacterias son capaces de desarrollar rápidamente mecanismos de resistencia a través de múltiples vías incluyendo la alteración o inactivación del antibiótico, la modificación de la diana o una vía metabólica para evitar su efecto dañino, solo por mencionar algunos (Urban-Chmiel et al., 2022).
Las nanopartículas se basan en mecanismos antibacterianos completamente diferentes a los de los antibióticos, proporcionando una alternativa convincente (Webster y Seil, 2012; Usman et al., 2024) (Figura 6). La superficie específica de las nanopartículas aumenta a medida que disminuye su tamaño, lo cual permite una mayor interacción del material con el entorno. La composición química, la concentración, el tamaño, su carga y la forma de las nanopartículas son algunas de las variables más relevantes con influencia en la actividad antibacteriana (Webster y Seil, 2012; Carrouel et al., 2020).
Figura 6
Mecanismo de acción antibacteriano de las nanopartículas.
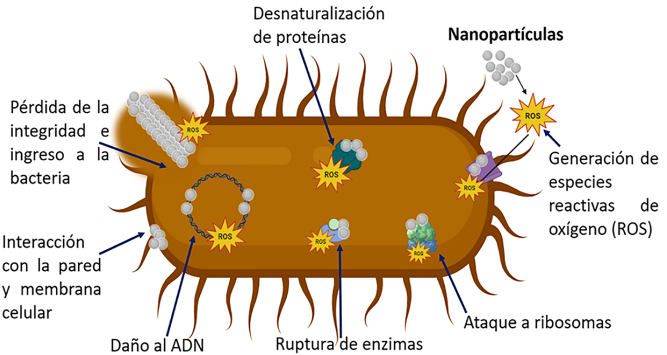
Fuente: Elaboración de los autores (software BioRender).
La capacidad antibacteriana de las nanopartículas se relaciona con su tamaño nanométrico, presentan una mayor relación volumen/superficie, proporcionándoles una interacción considerablemente más grande con las estructuras microbianas y así ejercer su actividad antibacteriana (Navya y Daima, 2016), además de que llevan a la generación de especies reactivas de oxígeno (ROS), incluyendo al radical hidroxilo (•OH), peróxido de hidrógeno (H2O2) y el radical anión superóxido (•O2-), moléculas altamente oxidantes, así como la liberación de iones, lo cual afecta a las proteínas y al ADN de las bacterias, aunado a que estas no han desarrollado mecanismos de resistencia muy eficientes contra las nanopartículas (Sirelkhatim et al., 2015; Abdal Dayem et al., 2017).
En específico, el mecanismo antibacteriano de las nanopartículas no está completamente desarrollado, pero se han descrito varios procesos como su interacción con la pared celular bacteriana causando perturbaciones en sus funciones o en las de la membrana celular (Linklater et al., 2020). Las nanopartículas, dependiendo de su tamaño, tendrán una mayor superficie permitiendo un incremento en la interacción con la pared o membrana, provocando su alteración y posterior permeabilidad (Król et al., 2017). Las bacterias Gram negativas son más susceptibles al daño en la membrana porque contienen lipopolisacáridos en la membrana externa, lo cual aumenta la carga negativa, en comparación con las bacterias Gram positivas que no tienen esta estructura (Beveridge, 1999).
Quizá el mecanismo antibacteriano más relevante de las nanopartículas es la generación de las especies reactivas de oxígeno (ROS, por sus siglas en inglés), estas especies se originan en la superficie de las nanopartículas como resultado del cambio en las propiedades electrónicas, a menor tamaño de partícula hay mayor interacción con el oxígeno molecular o el agua del medio y los sitios activos donantes y aceptores de electrones, generando una cascada de reacciones y, por consiguiente, un aumento en la concentración de estas especies (Abdal Dayem et al., 2017; Ali et al., 2018; Sivakumar et al., 2018). Uno de los blancos de las ROS es la cadena transportadora de electrones, lo cual lleva a una disminución de la producción de adenosín trifosfato (ATP), compuesto importante en la respiración y metabolismo bacteriano que al atacar enzimas involucradas en el metabolismo provocan daños en otros procesos como la síntesis de proteínas, lípidos, pared celular, etc. (Jiang, Lin y Cai, 2020). Otra consecuencia es la peroxidación de lípidos conducente a un daño en la integridad de la membrana y a cambios conformacionales en las proteínas de membrana. Este desequilibrio entre oxidantes y antioxidantes causa estrés oxidativo dentro de la bacteria provocando la muerte celular (Dutta et al., 2012).
La carga global de la membrana y pared de las células bacterianas es negativa debido al exceso de grupos carboxílicos disociados, las nanopartículas tienen generalmente una carga positiva, como resultado, las cargas opuestas generan una fuerte atracción electrostática, produciendo un daño debido a su acumulación en estas zonas (Sirelkhatim et al., 2015).
Las nanopartículas también pueden ingresar a la bacteria, interaccionando con las proteínas, enzimas y el ADN, teniendo un efecto significativo en la inhibición de su metabolismo y la ruptura del sistema enzimático, este daño se ve incrementado cuando las nanopartículas liberan iones de manera sostenida (Chiriac et al., 2016). Inclusive, las nanopartículas pueden mejorar la actividad de los antibióticos en las bacterias, al alterar la permeabilidad de las membranas y mejorar la liberación del fármaco, lo cual sugiere un efecto sinérgico en la lucha contra las infecciones bacterianas cada vez más resistentes a los antibióticos (Ipe et al., 2020; Haji, Ali y Aka, 2022). Las propiedades antibacterianas de las nanopartículas se han utilizado, por ejemplo, para revestir superficies que evitan la adhesión microbiana y así reducir la formación de biopelícula (Borzabadi-Farahani, Borzabadi y Lynch, 2014), lo cual es especialmente importante en el área odontológica (Reyes-Carmona et al., 2023).
El abanico de aplicaciones de las nanopartículas en contextos antibacterianos es enorme, desde su uso médico, industrial, textil y alimenticio, haciéndolas sumamente interesantes para seguir estudiando sus procesos de síntesis y potenciar sus aplicaciones.
Conclusiones y perspectivas
La química verde ha revolucionado la síntesis de nanopartículas, al utilizar métodos amigables con el ambiente, eficientes y sin los daños colaterales asociados con los métodos tradicionales. La adopción de la química verde no solo reduce el impacto ambiental de la síntesis de nanopartículas, sino que también promueve la seguridad en su producción y uso, un aspecto crucial cuando se consideran aplicaciones médicas y de consumo.
Las nanopartículas han demostrado propiedades antibacterianas significativas, abriendo nuevas posibilidades en la lucha contra las infecciones bacterianas, especialmente en la situación donde la resistencia a los antibióticos es una creciente preocupación, además de su incorporación en materiales para prevenir la proliferación bacteriana.
Aunque los resultados son prometedores, aún queda mucho por estudiar en cuanto a la optimización de la síntesis, propiedades, la evaluación de su toxicidad y la eficacia para su posible uso clínico o con el cada vez más demandante campo de aplicaciones de estas nanoestructuras, sentando las bases para futuras investigaciones en este campo emergente.
Agradecimientos
Agradecimientos: Rafael Álvarez Chimal agradece el apoyo del Consejo Nacional de Humanidades, Ciencias y Tecnologías (Conahcyt) por la beca postdoctoral. Los autores también agradecen al Dr. Samuel Tehuacanero Cuapa, Arq. Diego Quiteiro Vargas y Fís. Roberto Hernández Reyes por el soporte técnico. El apoyo financiero fue proporcionado por los proyectos DGAPA-UNAM-PAPIIT-IN202924, y Conahcyt A1-S-9178.
Referencias
Abdal Dayem, Ahmed, Mohammed Hossain, Soo Lee, Kyeongseok Kim, Subbroto Saha, Gwang-Mo Yang, Hye Choi y Ssang-Goo Cho. (2017).The role of reactive oxygen species (ROS) in the biological activities of metallic nanoparticles. International Journal of Molecular Sciences, 18(1): 120. https://doi.org/10.3390/ijms18010120.
Ahmed Abdal Dayem Mohammed Hossain Soo Lee Kyeongseok Kim Subbroto Saha Gwang-Mo Yang Hye Choi Ssang-Goo Cho 2017The role of reactive oxygen species (ROS) in the biological activities of metallic nanoparticlesInternational Journal of Molecular Sciences18112010.3390/ijms18010120
Agarwal, Happy, S. Venkat Kumar y S. Rajeshkumar. (2017). A review on green synthesis of zinc oxide nanoparticles - An eco-friendly approach. Resource-Efficient Technologies, 3(4): 406-13. https://doi.org/10.1016/j.reffit.2017.03.002.
Happy Agarwal S. Venkat Kumar S. Rajeshkumar 2017A review on green synthesis of zinc oxide nanoparticles - An eco-friendly approachResource-Efficient Technologies3440641310.1016/j.reffit.2017.03.002
Ali, Jawad, Rabia Irshad, Baoshan Li, Kamran Tahir, Aftab Ahmad, Muhammad Shakeel, Naeem Ullah Khan y Zia Ul Haq Khan. (2018). Synthesis and characterization of phytochemical fabricated zinc oxide nanoparticles with enhanced antibacterial and catalytic applications. Journal of Photochemistry and Photobiology B: Biology, 183: 349-56, junio. https://doi.org/10.1016/j.jphotobiol.2018.05.006.
Jawad Ali Rabia Irshad Baoshan Li Kamran Tahir Aftab Ahmad Muhammad Shakeel Naeem Ullah Khan Zia Ul Haq Khan 062018Synthesis and characterization of phytochemical fabricated zinc oxide nanoparticles with enhanced antibacterial and catalytic applicationsJournal of Photochemistry and Photobiology B: Biology183349356junio10.1016/j.jphotobiol.2018.05.006
Álvarez-Chimal, Rafael, Víctor I. García-Pérez, Marco Antonio Álvarez-Pérez, Rosario Tavera-Hernández, Lorena Reyes-Carmona, Miryam Martínez-Hernández y Jesús Ángel Arenas-Alatorre. (2022). Influence of the particle size on the antibacterial activity of green synthesized zinc oxide nanoparticles using dysphania ambrosioides extract, supported by molecular docking analysis. Arabian Journal of Chemistry, 15(6): 103804. https://doi.org/10.1016/j.arabjc.2022.103804.
Rafael Álvarez-Chimal Víctor I. García-Pérez Marco Antonio Álvarez-Pérez Rosario Tavera-Hernández Lorena Reyes-Carmona Miryam Martínez-Hernández Jesús Ángel Arenas-Alatorre 2022Influence of the particle size on the antibacterial activity of green synthesized zinc oxide nanoparticles using dysphania ambrosioides extract, supported by molecular docking analysisArabian Journal of Chemistry15610380410.1016/j.arabjc.2022.103804
Álvarez-Chimal, Rafael, Víctor Irahuen García-Pérez, Marco Antonio Álvarez-Pérez y Jesús Ángel Arenas-Alatorre. (2021). Green synthesis of ZnO nanoparticles using a dysphania ambrosioides extract. Structural characterization and antibacterial properties. Materials Science and Engineering: C, 118: 111540, enero. https://doi.org/10.1016/j.msec.2020.111540.
Rafael Álvarez-Chimal Víctor Irahuen García-Pérez Marco Antonio Álvarez-Pérez Jesús Ángel Arenas-Alatorre 012021Green synthesis of ZnO nanoparticles using a dysphania ambrosioides extract. Structural characterization and antibacterial propertiesMaterials Science and Engineering: C118111540enero10.1016/j.msec.2020.111540
Anees, Arshi, Rishil Gupta, P. V. Phanindra, Oluwatoyin Adenike Fabiyi, Uday Kumar Thera, Tesleem Taye Bello y Faheem Ahmad. (2024). Green synthesis of nanoparticles and applications. Advanced Nanotechnology in Plants, 89-122. Boca Raton: CRC Press. https://doi.org/10.1201/b23308-7.
Arshi Anees Rishil Gupta P. V. Phanindra Oluwatoyin Adenike Fabiyi Uday Kumar Thera Tesleem Taye Bello Faheem Ahmad 2024Green synthesis of nanoparticles and applicationsAdvanced Nanotechnology in Plants89122Boca RatonCRC Press10.1201/b23308-7
Bayda, Samer, Muhammad Adeel, Tiziano Tuccinardi, Marco Cordani y Flavio Rizzolio. (2019). The history of nanoscience and nanotechnology: from chemical-physical applications to nanomedicine. Molecules, 25(1): 112. https://doi.org/10.3390/molecules25010112.
Samer Bayda Muhammad Adeel Tiziano Tuccinardi Marco Cordani Flavio Rizzolio 2019The history of nanoscience and nanotechnology: from chemical-physical applications to nanomedicineMolecules25111210.3390/molecules25010112
Beveridge, Terry J. (1999). Structures of Gram-negative cell walls and their derived membrane vesicles. Journal of Bacteriology, 181(16): 4725-33. https://doi.org/10.1128/JB.181.16.4725-4733.1999.
Terry J. Beveridge 1999Structures of Gram-negative cell walls and their derived membrane vesiclesJournal of Bacteriology181164725473310.1128/JB.181.16.4725-4733.1999
Borzabadi-Farahani, Ali, Ebrahim Borzabadi y Edward Lynch. (2014). Nanoparticles in orthodontics, a review of antimicrobial and anti-caries applications. Acta Odontologica Scandinavica, 72(6): 413-17. https://doi.org/10.3109/00016357.2013.859728.
Ali Borzabadi-Farahani Ebrahim Borzabadi Edward Lynch 2014Nanoparticles in orthodontics, a review of antimicrobial and anti-caries applicationsActa Odontologica Scandinavica72641341710.3109/00016357.2013.859728
Carrillo-López, Luis M., Ramón M. Soto-Hernández, Hilda A. Zavaleta-Mancera y Alfredo R. Vilchis-Néstor. (2016). Study of the performance of the organic extracts of Chenopodium ambrosioides for Ag nanoparticle synthesis. Journal of Nanomaterials, 2016: 1-13. https://doi.org/10.1155/2016/4714162.
Luis M. Carrillo-López Ramón M. Soto-Hernández Hilda A. Zavaleta-Mancera Alfredo R. Vilchis-Néstor 2016Study of the performance of the organic extracts of Chenopodium ambrosioides for Ag nanoparticle synthesisJournal of Nanomaterials201611310.1155/2016/4714162
Carrouel, Florence, Stephane Viennot, Livia Ottolenghi, Cedric Gaillard y Denis Bourgeois. (2020). Nanoparticles as anti-microbial, anti-inflammatory, and remineralizing agents in oral care cosmetics: a review of the current situation. Nanomaterials, 10(1): 140. https://doi.org/10.3390/nano10010140.
Florence Carrouel Stephane Viennot Livia Ottolenghi Cedric Gaillard Denis Bourgeois 2020Nanoparticles as anti-microbial, anti-inflammatory, and remineralizing agents in oral care cosmetics: a review of the current situationNanomaterials10114010.3390/nano10010140
Chiriac, V., D. N. Stratulat, G. Calin, S. Nichitus, V. Burlui, C. Stadoleanu, M. Popa y I. M. Popa . (2016). Antimicrobial property of zinc based nanoparticles. IOP Conference Series: Materials Science and Engineering, 133(junio): 012055. https://doi.org/10.1088/1757-899X/133/1/012055.
V. Chiriac D. N. Stratulat G. Calin S. Nichitus V. Burlui C. Stadoleanu M. Popa I. M. Popa 062016Antimicrobial property of zinc based nanoparticlesIOP Conference Series: Materials Science and Engineering133junio01205510.1088/1757-899X/133/1/012055
Dada, Adewumi O., Folahan A. Adekola, Oluyomi S. Adeyemi, Oluwasesan M. Bello, Adetunji C. Oluwaseun, Oluwakemi J. Awakan, y Femi-Adepoju A. Grace. (2018). Exploring the effect of operational factors and characterization imperative to the synthesis of silver nanoparticles. Silver Nanoparticles - Fabrication, Characterization and Applications. https://doi.org/10.5772/intechopen.76947.
Adewumi O. Dada Folahan A. Adekola Oluyomi S. Adeyemi Oluwasesan M. Bello Adetunji C. Oluwaseun Oluwakemi J. Awakan Femi-Adepoju A. Grace 2018Exploring the effect of operational factors and characterization imperative to the synthesis of silver nanoparticlesSilver Nanoparticles - Fabrication, Characterization and Applications10.5772/intechopen.76947
Dahoumane, Si Amar, Claude Yéprémian, Chakib Djédiat, Alain Couté, Fernand Fiévet, Thibaud Coradin y Roberta Brayner. (2014). A global approach of the mechanism involved in the biosynthesis of gold colloids using micro-algae. Journal of Nanoparticle Research, 16(10): 2607. https://doi.org/10.1007/s11051-014-2607-8.
Si Amar Dahoumane Claude Yéprémian Chakib Djédiat Alain Couté Fernand Fiévet Thibaud Coradin Roberta Brayner 2014A global approach of the mechanism involved in the biosynthesis of gold colloids using micro-algaeJournal of Nanoparticle Research1610260710.1007/s11051-014-2607-8
Darby, Elizabeth M., Eleftheria Trampari, Pauline Siasat, Maria Solsona Gaya, Ilyas Alav, Mark A. Webber y Jessica M. A. Blair. (2023). Molecular mechanisms of antibiotic resistance revisited. Nature Reviews Microbiology, 21(5): 280-95. https://doi.org/10.1038/s41579-022-00820-y.
Elizabeth M. Darby Eleftheria Trampari Pauline Siasat Maria Solsona Gaya Ilyas Alav Mark A. Webber Jessica M. A. Blair 2023Molecular mechanisms of antibiotic resistance revisitedNature Reviews Microbiology21528029510.1038/s41579-022-00820-y
Dauthal, Preeti y Mausumi Mukhopadhyay. (2016). Noble metal nanoparticles: plant-mediated synthesis, mechanistic aspects of synthesis, and applications. Industrial & Engineering Chemistry Research, 55(36): 9557-77. https://doi.org/10.1021/acs.iecr.6b00861.
Preeti Dauthal Mausumi Mukhopadhyay 2016Noble metal nanoparticles: plant-mediated synthesis, mechanistic aspects of synthesis, and applicationsIndustrial & Engineering Chemistry Research55369557957710.1021/acs.iecr.6b00861
Deljou, Ali y Samad Goudarzi. (2016). Green extracellular synthesis of the silver nanoparticles using thermophilic bacillus Sp. AZ1 and its antimicrobial activity against several human pathogenetic bacteria. Iranian Journal of Biotechnology, 14(2): 25-32. https://doi.org/10.15171/ijb.1259.
Ali Deljou Samad Goudarzi 2016Green extracellular synthesis of the silver nanoparticles using thermophilic bacillus Sp. AZ1 and its antimicrobial activity against several human pathogenetic bacteriaIranian Journal of Biotechnology142253210.15171/ijb.1259
Dutta, R.K., Bhavani P. Nenavathu, Mahesh K. Gangishetty y A.V. R. Reddy. (2012). Studies on antibacterial activity of ZnO nanoparticles by ROS induced lipid peroxidation. Colloids and Surfaces B: Biointerfaces, 94(junio): 143-50. https://doi.org/10.1016/j.colsurfb.2012.01.046.
R.K. Dutta Bhavani P. Nenavathu Mahesh K. Gangishetty A.V. R. Reddy 2012Studies on antibacterial activity of ZnO nanoparticles by ROS induced lipid peroxidationColloids and Surfaces B: Biointerfaces94junio14315010.1016/j.colsurfb.2012.01.046
Eaimsumang, Srisin, Sujitra Wongkasemjit, Sangobtip Pongstabodee, Siwaporn Meejoo Smith, Sukritthira Ratanawilai, Nuwong Chollacoop y Apanee Luengnaruemitchai. (2019). Effect of synthesis time on morphology of CeO2 nanoparticles and Au/CeO2 and their activity in oxidative steam reforming of methanol. Journal of Rare Earths, 37(8): 819-28. https://doi.org/10.1016/j.jre.2018.11.010.
Srisin Eaimsumang Sujitra Wongkasemjit Sangobtip Pongstabodee Siwaporn Meejoo Smith Sukritthira Ratanawilai Nuwong Chollacoop Apanee Luengnaruemitchai 2019Effect of synthesis time on morphology of CeO2 nanoparticles and Au/CeO2 and their activity in oxidative steam reforming of methanolJournal of Rare Earths37881982810.1016/j.jre.2018.11.010
Geetha, Karra, Mounika Yekkala y R. Shireesh Kiran. (2024). A review of revolutionizing green synthesis of nanoparticles in pharmacy and healthcare. Journal of Pharmaceutical Research International, 36(5): 25-40. https://doi.org/10.9734/jpri/2024/v36i57515.
Karra Geetha Mounika Yekkala R. Shireesh Kiran 2024A review of revolutionizing green synthesis of nanoparticles in pharmacy and healthcareJournal of Pharmaceutical Research International365254010.9734/jpri/2024/v36i57515
Ghasemi, Saeed, Sara Dabirian, Faezeh Kariminejad, Diba Eghbali Koohi, Mehran Nemattalab, Sina Majidimoghadam, Ehsan Zamani y Fatemeh Yousefbeyk. (2024). Process optimization for green synthesis of silver nanoparticles using rubus discolor leaves extract and its biological activities against multi-drug resistant bacteria and cancer cells. Scientific Reports, 14(1): 4130. https://doi.org/10.1038/s41598-024-54702-9.
Saeed Ghasemi Sara Dabirian Faezeh Kariminejad Diba Eghbali Koohi Mehran Nemattalab Sina Majidimoghadam Ehsan Zamani Fatemeh Yousefbeyk 2024Process optimization for green synthesis of silver nanoparticles using rubus discolor leaves extract and its biological activities against multi-drug resistant bacteria and cancer cellsScientific Reports141413010.1038/s41598-024-54702-9
Gupta, Deepshikha, Anuj Boora, Amisha Thakur y Tejendra K. Gupta. (2023). Green and sustainable synthesis of nanomaterials: recent advancements and limitations. Environmental Research, 231(agosto): 116316. https://doi.org/10.1016/j.envres.2023.116316.
Deepshikha Gupta Anuj Boora Amisha Thakur Tejendra K. Gupta 082023Green and sustainable synthesis of nanomaterials: recent advancements and limitationsEnvironmental Research231agosto11631610.1016/j.envres.2023.116316
Haji, Sayran Hamad, Fattma A. Ali y Safaa Toma Hanna Aka. (2022). Synergistic antibacterial activity of silver nanoparticles biosynthesized by carbapenem-resistant Gram-negative bacilli. Scientific Reports, 12(1): 15254. https://doi.org/10.1038/s41598-022-19698-0.
Sayran Hamad Haji Fattma A. Ali Safaa Toma Hanna Aka 2022Synergistic antibacterial activity of silver nanoparticles biosynthesized by carbapenem-resistant Gram-negative bacilliScientific Reports1211525410.1038/s41598-022-19698-0
Handayani, W., A. S. Ningrum y C. Imawan. (2020). The role of pH in synthesis silver nanoparticles using pometia pinnata (matoa) leaves extract as bioreductor. Journal of Physics: Conference Series, 1428(1): 012021. https://doi.org/10.1088/1742-6596/1428/1/012021.
W. Handayani A. S. Ningrum C. Imawan 2020The role of pH in synthesis silver nanoparticles using pometia pinnata (matoa) leaves extract as bioreductorJournal of Physics: Conference Series1428101202110.1088/1742-6596/1428/1/012021
Hebbalalu, Deepika, Jacob Lalley, Mallikarjuna N. Nadagouda y Rajender S. Varma. (2013). Greener techniques for the synthesis of silver nanoparticles using plant extracts, enzymes, bacteria, biodegradable polymers, and Microwaves. ACS Sustainable Chemistry & Engineering, 1(7): 703-12. https://doi.org/10.1021/sc4000362.
Deepika Hebbalalu Jacob Lalley Mallikarjuna N. Nadagouda Rajender S. Varma 2013Greener techniques for the synthesis of silver nanoparticles using plant extracts, enzymes, bacteria, biodegradable polymers, and MicrowavesACS Sustainable Chemistry & Engineering1770371210.1021/sc4000362
Ijaz, Irfan, Ezaz Gilani, Ammara Nazir y Aysha Bukhari. (2020). Detail review on chemical, physical and green synthesis, classification, characterizations and applications of nanoparticles. Green Chemistry Letters and Reviews, 13(3): 223-45. https://doi.org/10.1080/17518253.2020.1802517.
Irfan Ijaz Ezaz Gilani Ammara Nazir Aysha Bukhari 2020Detail review on chemical, physical and green synthesis, classification, characterizations and applications of nanoparticlesGreen Chemistry Letters and Reviews13322324510.1080/17518253.2020.1802517
Ipe, Deepak S., P. T. Sudheesh Kumar, Robert M. Love y Stephen M. Hamlet. (2020). Silver nanoparticles at biocompatible dosage synergistically increases bacterial susceptibility to antibiotics. Frontiers in Microbiology, 11(mayo). https://doi.org/10.3389/fmicb.2020.01074.
Deepak S. Ipe P. T. Sudheesh Kumar Robert M. Love Stephen M. Hamlet 052020Silver nanoparticles at biocompatible dosage synergistically increases bacterial susceptibility to antibioticsFrontiers in Microbiology11mayo10.3389/fmicb.2020.01074
Jiang, Shengjie, Kaili Lin y Ming Cai. (2020). ZnO nanomaterials: current advancements in antibacterial mechanisms and applications. Frontiers in Chemistry, 8 (July). https://doi.org/10.3389/fchem.2020.00580.
Shengjie Jiang Kaili Lin Ming Cai 072020ZnO nanomaterials: current advancements in antibacterial mechanisms and applicationsFrontiers in Chemistry8July10.3389/fchem.2020.00580
Kazemi, S., A. Hosseingholian, S.D. Gohari, F. Feirahi, F. Moammeri, G. Mesbahian, Z.S. Moghaddam y Q. Ren. (2023). Recent advances in green synthesized nanoparticles: from production to application. Materials Today Sustainability, 24(diciembre): 100500. https://doi.org/10.1016/j.mtsust.2023.100500.
S. Kazemi A. Hosseingholian S.D. Gohari F. Feirahi F. Moammeri G. Mesbahian Z.S. Moghaddam Q. Ren 122023Recent advances in green synthesized nanoparticles: from production to applicationMaterials Today Sustainability24diciembre10050010.1016/j.mtsust.2023.100500
Kim, Hyun-seok, Yu Seon Seo, Kyeounghak Kim, Jeong Woo Han, Youmie Park y Seonho Cho. (2016). Concentration effect of reducing agents on green synthesis of gold nanoparticles: size, morphology, and growth mechanism. Nanoscale Research Letters, 11(1): 230. https://doi.org/10.1186/s11671-016-1393-x.
Hyun-seok Kim Yu Seon Seo Kyeounghak Kim Jeong Woo Han Youmie Park Seonho Cho 2016Concentration effect of reducing agents on green synthesis of gold nanoparticles: size, morphology, and growth mechanismNanoscale Research Letters11123010.1186/s11671-016-1393-x
Koul, Bhupendra, Anil Kumar Poonia, Dhananjay Yadav y Jun-O Jin. (2021). Microbe-mediated biosynthesis of nanoparticles: applications and future prospects. Biomolecules, 11(6): 886. https://doi.org/10.3390/biom11060886.
Bhupendra Koul Anil Kumar Poonia Dhananjay Yadav Jun-O Jin 2021Microbe-mediated biosynthesis of nanoparticles: applications and future prospectsBiomolecules11688610.3390/biom11060886
Król, A., P. Pomastowski, K. Rafińska, V. Railean-Plugaru y B. Buszewski. (2017). Zinc oxide nanoparticles: synthesis, antiseptic activity and toxicity mechanism. Advances in Colloid and Interface Science, 249: 37-52, noviembre. https://doi.org/10.1016/j.cis.2017.07.033.
A. Król P. Pomastowski K. Rafińska V. Railean-Plugaru B. Buszewski 112017Zinc oxide nanoparticles: synthesis, antiseptic activity and toxicity mechanismAdvances in Colloid and Interface Science2493752noviembre10.1016/j.cis.2017.07.033
Kučuk, Nika, Mateja Primožič, Željko Knez y Maja Leitgeb. (2023). Sustainable biodegradable biopolymer-based nanoparticles for healthcare applications. International Journal of Molecular Sciences, 24(4): 3188. https://doi.org/10.3390/ijms24043188.
Nika Kučuk Mateja Primožič Željko Knez Maja Leitgeb 2023Sustainable biodegradable biopolymer-based nanoparticles for healthcare applicationsInternational Journal of Molecular Sciences244318810.3390/ijms24043188
Kumar, Sanjay, Pulak Bhushan y Shantanu Bhattacharya. (2018). Fabrication of nanostructures with bottom-up approach and their utility in diagnostics, therapeutics, and others. PubMed Central, 167-198. https://doi.org/10.1007/978-981-10-7751-7_8.
Sanjay Kumar Pulak Bhushan Shantanu Bhattacharya 2018Fabrication of nanostructures with bottom-up approach and their utility in diagnostics, therapeutics, and othersPubMed Central16719810.1007/978-981-10-7751-7_8
Kuppusamy, Palaniselvam, Mashitah M. Yusoff, Gaanty Pragas Maniam y Natanamurugaraj Govindan. (2016). Biosynthesis of metallic nanoparticles using plant derivatives and their new avenues in pharmacological applications - An updated report. Saudi Pharmaceutical Journal, 24(4): 473-84. https://doi.org/10.1016/j.jsps.2014.11.013.
Palaniselvam Kuppusamy Mashitah M. Yusoff Gaanty Pragas Maniam Natanamurugaraj Govindan 2016Biosynthesis of metallic nanoparticles using plant derivatives and their new avenues in pharmacological applications - An updated reportSaudi Pharmaceutical Journal24447348410.1016/j.jsps.2014.11.013
Linklater, Denver P., Vladimir A. Baulin, Xavier Le Guével, Jean‐Baptiste Fleury, Eric Hanssen, The Hong Phong Nguyen, Saulius Juodkazis et al. (2020). Antibacterial action of nanoparticles by lethal stretching of bacterial cell membranes. Advanced Materials, 32(52). https://doi.org/10.1002/adma.202005679.
Denver P. Linklater Vladimir A. Baulin Xavier Le Guével Jean‐Baptiste Fleury Eric Hanssen The Hong Phong Nguyen Saulius Juodkazis 2020Antibacterial action of nanoparticles by lethal stretching of bacterial cell membranesAdvanced Materials325210.1002/adma.202005679
Majumdar, Moumita, Saurabh Shivalkar, Ayantika Pal, Madan L. Verma, Amaresh Kumar Sahoo y Dijendra Nath Roy. (2020). Nanotechnology for enhanced bioactivity of bioactive compounds. Biotechnological Production of Bioactive Compounds, 433-66. Elsevier. https://doi.org/10.1016/B978-0-444-64323-0.00015-1.
Moumita Majumdar Saurabh Shivalkar Ayantika Pal Madan L. Verma Amaresh Kumar Sahoo Dijendra Nath Roy 2020Nanotechnology for enhanced bioactivity of bioactive compoundsBiotechnological Production of Bioactive Compounds433466Elsevier10.1016/B978-0-444-64323-0.00015-1
Makarov, V. V., A. J. Love, O. V. Sinitsyna, S. S. Makarova, I. V. Yaminsky, M. E. Taliansky y N. O. Kalinina. (2014). ‘Green’ nanotechnologies: synthesis of metal nanoparticles using plants. Acta Naturae, 6(1): 35-44. https://doi.org/10.32607/20758251-2014-6-1-35-44.
V. V. Makarov A. J. Love O. V. Sinitsyna S. S. Makarova I. V. Yaminsky M. E. Taliansky N. O. Kalinina 2014‘Green’ nanotechnologies: synthesis of metal nanoparticles using plantsActa Naturae61354410.32607/20758251-2014-6-1-35-44
Messaoudi, Omar y Mourad Bendahou. (2020). Biological synthesis of nanoparticles using endophytic microorganisms: current development. Nanotechnology and the Environment. IntechOpen. https://doi.org/10.5772/intechopen.93734.
Omar Messaoudi Mourad Bendahou 2020Biological synthesis of nanoparticles using endophytic microorganisms: current developmentNanotechnology and the EnvironmentIntechOpen10.5772/intechopen.93734
Mo, Lixin, Zhenxin Guo, Li Yang, Qingqing Zhang, Yi Fang, Zhiqing Xin, Zheng Chen, Kun Hu, Lu Han y Luhai Li. (2019). Silver nanoparticles based ink with moderate sintering in flexible and printed electronics. International Journal of Molecular Sciences, 20(9): 2124. https://doi.org/10.3390/ijms20092124.
Lixin Mo Zhenxin Guo Li Yang Qingqing Zhang Yi Fang Zhiqing Xin Zheng Chen Kun Hu Lu Han Luhai Li 2019Silver nanoparticles based ink with moderate sintering in flexible and printed electronicsInternational Journal of Molecular Sciences209212410.3390/ijms20092124
Moradi, Farhad, Arshin Ghaedi, Zahra Fooladfar y Aida Bazrgar. (2023). Recent advance on nanoparticles or nanomaterials with anti-multidrug resistant bacteria and anti-bacterial biofilm properties: a systematic review. Heliyon, 9(11): e22105. https://doi.org/10.1016/j.heliyon.2023.e22105.
Farhad Moradi Arshin Ghaedi Zahra Fooladfar Aida Bazrgar 2023Recent advance on nanoparticles or nanomaterials with anti-multidrug resistant bacteria and anti-bacterial biofilm properties: a systematic reviewHeliyon911e2210510.1016/j.heliyon.2023.e22105
Mukherjee, Priyabrata, Absar Ahmad, Deendayal Mandal, Satyajyoti Senapati, Sudhakar R. Sainkar, Mohammad I. Khan, Renu Parishcha et al. (2001). Fungus-mediated synthesis of silver nanoparticles and their immobilization in the mycelial matrix: a novel biological approach to nanoparticle synthesis. Nano Letters, 1(10): 515-19. https://doi.org/10.1021/nl0155274.
Priyabrata Mukherjee Absar Ahmad Deendayal Mandal Satyajyoti Senapati Sudhakar R. Sainkar Mohammad I. Khan Renu Parishcha 2001Fungus-mediated synthesis of silver nanoparticles and their immobilization in the mycelial matrix: a novel biological approach to nanoparticle synthesisNano Letters11051551910.1021/nl0155274
Naikoo, Gowhar A., Mujahid Mustaqeem, Israr U. Hassan, Tasbiha Awan, Fareeha Arshad, Hiba Salim y Ahsanulhaq Qurashi. (2021). Bioinspired and green synthesis of nanoparticles from plant extracts with antiviral and antimicrobial properties: a critical review. Journal of Saudi Chemical Society, 25(9): 101304. https://doi.org/10.1016/j.jscs.2021.101304.
Gowhar A. Naikoo Mujahid Mustaqeem Israr U. Hassan Tasbiha Awan Fareeha Arshad Hiba Salim Ahsanulhaq Qurashi 2021Bioinspired and green synthesis of nanoparticles from plant extracts with antiviral and antimicrobial properties: a critical reviewJournal of Saudi Chemical Society25910130410.1016/j.jscs.2021.101304
Nasrollahzadeh, Mahmoud, Monireh Atarod, Mohaddeseh Sajjadi, S. Mohammad Sajadi y Zahra Issaabadi. (2019). Plant-mediated green synthesis of nanostructures: mechanisms, characterization, and applications. Interface Science and Technology, 28: 199-322. https://doi.org/10.1016/B978-0-12-813586-0.00006-7.
Mahmoud Nasrollahzadeh Monireh Atarod Mohaddeseh Sajjadi S. Mohammad Sajadi Zahra Issaabadi 2019Plant-mediated green synthesis of nanostructures: mechanisms, characterization, and applicationsInterface Science and Technology2819932210.1016/B978-0-12-813586-0.00006-7
Nava, O. J., P. A. Luque, C. M. Gómez-Gutiérrez, A. R. Vilchis-Néstor, A. Castro-Beltrán, M.L. Mota-González y A. Olivas. (2017). Influence of Camellia sinensis extract on zinc oxide nanoparticle green synthesis. Journal of Molecular Structure, 1134: 121-25, abril. https://doi.org/10.1016/j.molstruc.2016.12.069.
O. J. Nava P. A. Luque C. M. Gómez-Gutiérrez A. R. Vilchis-Néstor A. Castro-Beltrán M.L. Mota-González A. Olivas 042017Influence of Camellia sinensis extract on zinc oxide nanoparticle green synthesisJournal of Molecular Structure1134121125abril10.1016/j.molstruc.2016.12.069
Navya, P. N. y Hemant Kumar Daima. (2016). Rational engineering of physicochemical properties of nanomaterials for biomedical applications with nanotoxicological perspectives. Nano Convergence, 3(1): 1. https://doi.org/10.1186/s40580-016-0064-z.
P. N. Navya Hemant Kumar Daima 2016Rational engineering of physicochemical properties of nanomaterials for biomedical applications with nanotoxicological perspectivesNano Convergence31110.1186/s40580-016-0064-z
Rana, Anu, Krishna Yadav y Sheeja Jagadevan. (2020). A comprehensive review on green synthesis of nature-inspired metal nanoparticles: mechanism, application and toxicity. Journal of Cleaner Production, 272: 122880, noviembre. https://doi.org/10.1016/j.jclepro.2020.122880.
Anu Rana Krishna Yadav Sheeja Jagadevan 112020A comprehensive review on green synthesis of nature-inspired metal nanoparticles: mechanism, application and toxicityJournal of Cleaner Production272122880noviembre10.1016/j.jclepro.2020.122880
Reyes-Carmona, Lorena, Enrique Camps, Enrique Campos-González, Gabriela Mercado-Celis, Alejandra Cervantes-Garduño, Ezequiel A. Pérez-Ibarra, Rafael Álvarez-Chimal, Sandra E. Rodil y Argelia Almaguer-Flores. (2023). Antimicrobial evaluation of bismuth subsalicylate nanoparticles synthesized by laser ablation against clinical oral microorganisms. Optics & Laser Technology, 158: 108930, febrero. https://doi.org/10.1016/j.optlastec.2022.108930.
Lorena Reyes-Carmona Enrique Camps Enrique Campos-González Gabriela Mercado-Celis Alejandra Cervantes-Garduño Ezequiel A. Pérez-Ibarra Rafael Álvarez-Chimal Sandra E. Rodil Argelia Almaguer-Flores 022023Antimicrobial evaluation of bismuth subsalicylate nanoparticles synthesized by laser ablation against clinical oral microorganismsOptics & Laser Technology158108930febrero10.1016/j.optlastec.2022.108930
Riddin, T. L., M. Gericke y C. G. Whiteley. (2006). Analysis of the inter- and extracellular formation of platinum nanoparticles by Fusarium oxysporum f. Sp. Lycopersici using response surface methodology. Nanotechnology, 17(14): 3482-89. https://doi.org/10.1088/0957-4484/17/14/021.
T. L. Riddin M. Gericke C. G. Whiteley 2006Analysis of the inter- and extracellular formation of platinum nanoparticles by Fusarium oxysporum f. Sp. Lycopersici using response surface methodologyNanotechnology17143482348910.1088/0957-4484/17/14/021
Saim, Alex Kwasi, Faustin Nartey Kumah y Millicent Nkrumah Oppong. (2021). Extracellular and intracellular synthesis of gold and silver nanoparticles by living plants: a review. Nanotechnology for Environmental Engineering, 6(1): 1. https://doi.org/10.1007/s41204-020-00095-9.
Alex Kwasi Saim Faustin Nartey Kumah Millicent Nkrumah Oppong 2021Extracellular and intracellular synthesis of gold and silver nanoparticles by living plants: a reviewNanotechnology for Environmental Engineering61110.1007/s41204-020-00095-9
Singh, Anirudh, Pavan Kumar Gautam, Arushi Verma, Vishal Singh, Pingali M. Shivapriya, Saurabh Shivalkar, Amaresh Kumar Sahoo y Sintu Kumar Samanta. (2020). Green synthesis of metallic nanoparticles as effective alternatives to treat antibiotics resistant bacterial infections: a review. Biotechnology Reports, 25: e00427, marzo. https://doi.org/10.1016/j.btre.2020.e00427.
Anirudh Singh Pavan Kumar Gautam Arushi Verma Vishal Singh Pingali M. Shivapriya Saurabh Shivalkar Amaresh Kumar Sahoo Sintu Kumar Samanta 032020Green synthesis of metallic nanoparticles as effective alternatives to treat antibiotics resistant bacterial infections: a reviewBiotechnology Reports25e00427marzo10.1016/j.btre.2020.e00427
Singh, Jagpreet, Tanushree Dutta, Ki-Hyun Kim, Mohit Rawat, Pallabi Samddar y Pawan Kumar. (2018). ‘Green’ synthesis of metals and their oxide nanoparticles: applications for environmental remediation. Journal of Nanobiotechnology, 16(1): 84. https://doi.org/10.1186/s12951-018-0408-4.
Jagpreet Singh Tanushree Dutta Ki-Hyun Kim Mohit Rawat Pallabi Samddar Pawan Kumar 2018‘Green’ synthesis of metals and their oxide nanoparticles: applications for environmental remediationJournal of Nanobiotechnology1618410.1186/s12951-018-0408-4
Singh, Priyanka, Yu-Jin Kim, Dabing Zhang y Deok-Chun Yang. (2016). Biological synthesis of nanoparticles from plants and microorganisms. Trends in Biotechnology, 34(7): 588-99. https://doi.org/10.1016/j.tibtech.2016.02.006.
Priyanka Singh Yu-Jin Kim Dabing Zhang Deok-Chun Yang 2016Biological synthesis of nanoparticles from plants and microorganismsTrends in Biotechnology34758859910.1016/j.tibtech.2016.02.006
Sirelkhatim, Amna, Shahrom Mahmud, Azman Seeni, Noor Haida Mohamad Kaus, Ling Chuo Ann, Siti Khadijah Mohd Bakhori, Habsah Hasan y Dasmawati Mohamad. (2015). Review on zinc oxide nanoparticles: antibacterial activity and toxicity mechanism. Nano-Micro Letters, 7(3): 219-42. https://doi.org/10.1007/s40820-015-0040-x.
Amna Sirelkhatim Shahrom Mahmud Azman Seeni Noor Haida Mohamad Kaus Ling Chuo Ann Siti Khadijah Mohd Bakhori Habsah Hasan Dasmawati Mohamad 2015Review on zinc oxide nanoparticles: antibacterial activity and toxicity mechanismNano-Micro Letters7321924210.1007/s40820-015-0040-x
Sivakumar, Padmanaban, Minjong Lee, Yoon-Seok Kim y Min Suk Shim. (2018). Photo-triggered antibacterial and anticancer activities of zinc oxide nanoparticles. Journal of Materials Chemistry B, 6(30): 4852-71. https://doi.org/10.1039/C8TB00948A.
Padmanaban Sivakumar Minjong Lee Yoon-Seok Kim Min Suk Shim 2018Photo-triggered antibacterial and anticancer activities of zinc oxide nanoparticlesJournal of Materials Chemistry B6304852487110.1039/C8TB00948A
Solís-Sandí, Iván, Sara Cordero-Fuentes, Reinaldo Pereira-Reyes, José Roberto Vega-Baudrit, Diego Batista-Menezes y Gabriela Montes de Oca-Vásquez. (2023). Optimization of the biosynthesis of silver nanoparticles using bacterial extracts and their antimicrobial potential. Biotechnology Reports, 40(diciembre): e00816. https://doi.org/10.1016/j.btre.2023.e00816.
Iván Solís-Sandí Sara Cordero-Fuentes Reinaldo Pereira-Reyes José Roberto Vega-Baudrit Diego Batista-Menezes Gabriela Montes de Oca-Vásquez 122023Optimization of the biosynthesis of silver nanoparticles using bacterial extracts and their antimicrobial potentialBiotechnology Reports40diciembree0081610.1016/j.btre.2023.e00816
Stavinskaya, Oksana, Iryna Laguta, Tetiana Fesenko y Marina Krumova. (2019). Effect of temperature on green synthesis of silver nanoparticles using vitex agnus-castus extract. Chemistry Journal of Moldova, 14(2): 117-21. https://doi.org/10.19261/cjm.2019.636.
Oksana Stavinskaya Iryna Laguta Tetiana Fesenko Marina Krumova 2019Effect of temperature on green synthesis of silver nanoparticles using vitex agnus-castus extractChemistry Journal of Moldova14211712110.19261/cjm.2019.636
Syed, Asad y Absar Ahmad. (2012). Extracellular biosynthesis of platinum nanoparticles using the fungus Fusarium oxysporum. Colloids and Surfaces B: Biointerfaces, 97: 27-31, septiembre. https://doi.org/10.1016/j.colsurfb.2012.03.026.
Asad Syed Absar Ahmad 092012Extracellular biosynthesis of platinum nanoparticles using the fungus Fusarium oxysporumColloids and Surfaces B: Biointerfaces972731septiembre10.1016/j.colsurfb.2012.03.026
Thanh, Nguyen T. K., N. Maclean y S. Mahiddine. (2014). Mechanisms of nucleation and growth of nanoparticles in solution. Chemical Reviews, 114(15): 7610-30. https://doi.org/10.1021/cr400544s.
Nguyen T. K. Thanh N. Maclean S. Mahiddine 2014Mechanisms of nucleation and growth of nanoparticles in solutionChemical Reviews114157610763010.1021/cr400544s
Urban-Chmiel, Renata, Agnieszka Marek, Dagmara Stępień-Pyśniak, Kinga Wieczorek, Marta Dec, Anna Nowaczek y Jacek Osek. (2022). Antibiotic resistance in bacteria - A review. Antibiotics, 11(8): 1079. https://doi.org/10.3390/antibiotics11081079.
Renata Urban-Chmiel Agnieszka Marek Dagmara Stępień-Pyśniak Kinga Wieczorek Marta Dec Anna Nowaczek Jacek Osek 2022Antibiotic resistance in bacteria - A reviewAntibiotics118107910.3390/antibiotics11081079
Usman, Osama, Mirza Muhammad Mohsin Baig, Mujtaba Ikram, Tehreem Iqbal, Saharin Islam, Wajid Syed, Mahmood Basil A. Al-Rawi y Misbah Naseem. (2024). Green synthesis of metal nanoparticles and study their anti-pathogenic properties against pathogens effect on plants and animals. Scientific Reports, 14(1): 11354. https://doi.org/10.1038/s41598-024-61920-8.
Osama Usman Mirza Muhammad Mohsin Baig Mujtaba Ikram Tehreem Iqbal Saharin Islam Wajid Syed Mahmood Basil A. Al-Rawi Misbah Naseem 2024Green synthesis of metal nanoparticles and study their anti-pathogenic properties against pathogens effect on plants and animalsScientific Reports1411135410.1038/s41598-024-61920-8
Vetchinkina, Elena, Ekaterina Loshchinina, Maria Kupryashina, Andrey Burov, Timofey Pylaev y Valentina Nikitina. (2018). Green synthesis of nanoparticles with extracellular and intracellular extracts of basidiomycetes. PeerJ, 6: e5237, julio. https://doi.org/10.7717/peerj.5237.
Elena Vetchinkina Ekaterina Loshchinina Maria Kupryashina Andrey Burov Timofey Pylaev Valentina Nikitina 072018Green synthesis of nanoparticles with extracellular and intracellular extracts of basidiomycetesPeerJ6e5237julio10.7717/peerj.5237
Vijayaram, Seerengaraj, Hary Razafindralambo, Yun-Zhang Sun, Seerangaraj Vasantharaj, Hamed Ghafarifarsani, Seyed Hossein Hoseinifar y Mahdieh Raeeszadeh. (2024). Applications of green synthesized metal nanoparticles - A review. Biological Trace Element Research, 202(1): 360-86. https://doi.org/10.1007/s12011-023-03645-9.
Seerengaraj Vijayaram Hary Razafindralambo Yun-Zhang Sun Seerangaraj Vasantharaj Hamed Ghafarifarsani Seyed Hossein Hoseinifar Mahdieh Raeeszadeh 2024Applications of green synthesized metal nanoparticles - A reviewBiological Trace Element Research202136038610.1007/s12011-023-03645-9
Webster, Thomas J. y Iustin Seil. (2012). Antimicrobial applications of nanotechnology: methods and literature. International Journal of Nanomedicine, 2767, junio. https://doi.org/10.2147/IJN.S24805.
Thomas J. Webster Iustin Seil 062012Antimicrobial applications of nanotechnology: methods and literatureInternational Journal of Nanomedicine2767junio10.2147/IJN.S24805
Zhang, Lijie y Thomas J. Webster. (2009). Nanotechnology and nanomaterials: promises for improved tissue regeneration. Nano Today, 4(1): 66-80. https://doi.org/10.1016/j.nantod.2008.10.014.
Lijie Zhang Thomas J. Webster 2009Nanotechnology and nanomaterials: promises for improved tissue regenerationNano Today41668010.1016/j.nantod.2008.10.014