Introducción
Las resinas acrílicas son polímeros muy utilizados en odontología, pues constituyen
un material costeable, accesible y de fácil manipulación. (Frazer et al., 2005). Las resinas acrílicas de interés en odontología son las derivadas del ácido acrílico
y del ácido metacrílico, que polimerizan por adición y presentan propiedades adecuadas
en cuanto a su estabilidad fisicoquímica, manipulación y estética (Pfeiffer y Rosenbauer, 2004). El acrílico termopolimerizable es uno de los materiales cuyo uso se encuentra más
difundido en la actual práctica odontológica, con éste se fabrican, usualmente, tanto
dientes provisionales como bases para dentaduras parciales o totales, mediante la
polimerización de partículas de polvo de polimetilmetacrilato (PMMA) pre-polimerizado
mezcladas con monómero de metacrilato de metilo (MMA) (Wieckiewicz et al., 2016). Sin embargo, la frecuente colonización de las superficies acrílicas puede generar
la presencia de inflamación, dolor e infecciones que afectan a los pacientes que han
sido rehabilitados con este material. Diferentes especies de Candida y de bacterias se han aislado del 63.3% de las prótesis y de los tejidos bucales
de los pacientes desdentados en comparación con aquellos pacientes que conservan sus
dientes (Abbas A.Jafari et al., 2014). Debido a esto, la búsqueda de nuevas estrategias para la mejora de este material
es indispensable (Arenas-Arrocena et al., 2017).
El desarrollo en la manufactura de este tipo de polímeros es notable y se ve favorecido
por los avances tecnológicos actuales, resultando de particular interés para áreas
emergentes y prometedoras como la nanotecnología en donde en fechas recientes las
investigaciones se han enfocado en el desarrollo de polímeros combinados con NPS metálicas
(Allaker y Memarzadeh, 2014). La nanotecnología es considerada una tecnología reciente que partiendo de dimensiones
de 1 a 100 nm manipula los materiales con la finalidad de mejorar el diseño, elaboración
y propiedades de los mismos a nivel macroscópico (European-Commission 2014).
Con base en la nanoescala antes referida las partículas esféricas dentro de este rango
son denominadas nanopartículas (NPS) y éstas poseen propiedades únicas en relación
con su naturaleza, tamaño, distribución, morfología y tendencia a la aglomeración
(Uskokovic, 2013). Si bien la nanotecnología se ha visto inmersa en todos los campos de la odontología,
destaca principalmente su aplicación en la elaboración de materiales de restauración
para potenciar sus propiedades y conferirles otras deseables, como propiedades antibacterianas;
este potencial efecto resulta de particular interés en materiales que se utilicen
para aplicaciones clínicas que impliquen un mayor riesgo para el desarrollo y crecimiento
bacteriano, como lo son las bases para dentaduras (Hannig y Hannig, 2013).
Las nanopartículas metálicas más utilizadas y estudiadas en cuanto a su efecto antibacterial
son las de dióxido de titanio, plata y óxido de zinc. Sin embargo en fechas recientes
las nanopartículas de cobre (Cu NPS) han resultado un área de interés debido a sus
propiedades antimicrobianas y antifúngicas, lo que lo hace un elemento promisorio
y potencialmente viable para distintas aplicaciones(Camacho-Flores et al., 2015). En un estudio in vitro evaluó la actividad antimicrobiana de las Cu NPS y se encontró que la concentración
mínima inhibitoria (MIC) fue de 10 μg/ml para E. coli, mientras que para S. aureus y S. mutans fue de 100 μg/ml. (Argueta-Figueroa et al., 2014), sin embargo no se evaluó la biocompatibilidad. Al revisar la literatura es notorio
que se ha determinado dicha actividad antimicrobiana en las nanopartículas metálicas,
pero es infrecuente que también se evalué simultáneamente su citotoxicidad. En otro
estudio, se determinó la citotoxicidad en células provenientes de la epidermis de
la piel humana de micropartículas y NPS de óxido de cobre (II) (CuO) así como de cloruro
de cobre (CuCl2), con fines de comparación, el contenido de cobre en todos los grupos fue equivalente
a 0.21 mg/ml (170 ppm) y se encontró que la viabilidad celular disminuyó al 50% con
las micropartículas de CuO, al 87% con NPS de CuO, y al 83% con CuCl2 (Cohen et al. 2013). Sin embargo, se ha postulado que el análisis del impacto biológico y los posibles
efectos citotóxicos de los materiales, y en especial de las nanopartículas, debido
a sus interacciones a nivel celular, deben ser determinados a la par, con la finalidad
de ponderar el riesgo-beneficio de dichos materiales para un uso eficiente y responsable
(García-Contreras et al., 2015).
Por lo tanto, el propósito de este estudio fue determinar la inhibición bacteriana
(sobre S. aureus, E. coli y E. faecalis) así como la citotoxicidad (sobre fibroblastos gingivales humanos) de acrílico termopolimerizable
(PMMA) enriquecido con nanopartículas de cobre.
Material y método
Materiales
Cloruro de cobre (CuCl2, Sigma-Aldrich, St Luis, MO, EUA.), borohidruro de sodio (NaBH4, Sigma-Aldrich), citrato de sodio (Na3C6H5O7, Sigma-Aldrich), alcohol isopropílico (Karal, S. A. de C. V. León, Gto., México),
yeso (Tipo IV, Manufacturera Dental Continental S. A. de C. V. México), separador
yeso- yeso (Mcd dental, Zapopan, Jal. México), acrílico termopolimerizable (PMMA,
Opticryl, New Stetic, Powerline Road, Florida, EUA), metilmetacrilato (Opticryl, New
Stetic), caldo Mueller-Hinton (Sigma-Aldrich), agar Mueller-Hinton (Sigma-Aldrich),
3-(4,5- dimetiltiazol-2-ilo)-2,5-difeniltetrazol (MTT, Sigma-Aldrich), dimetilsulfóxido
(DMSO, J. T. Baker, Phillipsburg, NJ, EUA), Alfa Modificación del Medio de Eagle (α-mem,
Life Technologies, Gibco®, Gran Island, NY, EUA), suero fetal bovino (FBS, Life Technologies,
Gibco®), penicilina/estreptomicina (Life Technologies, Gibco®) y Glutamax (Life Technologies,
Gibco®), tripsina (Life Technologies, Gibco®), EDTA-2Na (Life Technologies, Gibco®),
solución buffer (PBS(-), Life Technologies, Gibco®).
Síntesis de las nanopartículas de cobre
La síntesis de Cu NPS se realizó mediante el método de reducción química de acuerdo
con un método previamente reportado (Argueta-Figueroa et al., 2014) con ligeras modificaciones; se empleó CuCl2 como precursor, NaBH4 como agente reductor y citrato de sodio como agente estabilizador, este último se
agregó a la solución de las nanopartículas de cobre cuando la reacción se completó
y se mantuvo en agitación por 10 minutos más. El producto obtenido, se lavó con acetona
tres veces con el propósito de retirar residuos de la reacción. Las nanopartículas
se suspendieron en agua deionizada, alcohol isopropílico, o se secaron a 60 ºC antes
de realizar los análisis correspondientes de acuerdo a la naturaleza de cada prueba
como se describe a continuación en las secciones posteriores.
Caracterización de nanopartículas
Se llevó a cabo la caracterización de las nanopartículas de cobre suspendidas en solución
acuosa a través del análisis Uv-vis, empleando un espectrofotómetro (Thermo Scientific,
St. Luis, MO, EUA). El espectro obtuvo en un rango de 400-800 nm.
El análisis de tamaño de partícula y morfología se realizó mediante microscopía de
transmisión electrónica, TEM (JEOL mod. JEM-1010). Las nanopartículas de cobre se
suspendieron en alcohol isopropílico, se sonicaron durante media hora y se colocó
una gota en una rejilla de cobre recubierta con fomvar y carbono para la obtención
de las micrografías.
Por otro lado, la fase cristalina y la composición de las nanopartículas de cobre
se determinaron a través de difracción de rayos X (DRX), utilizando un difractómetro
Bruker D8 Advance de rayos X (Frankfurt, Alemania), operado a 35 kV, 30 mA, con radiación
CuKa1 (longitud de onda λ = 1,5406 Å) y filtro de cobre. El difractograma de rayos
X se obtuvo en un rango de 2θ de 0° a 80° con una velocidad de paso de 0.049°.
Procesamiento de los discos de acrílico termopolimerizable (PMMA)
Se fabricaron discos de cera rosa toda estación con un tamaño de 15 mm de diámetro
con un grosor de 3 mm, lo cual permitió que los discos fueran colocados en los pocillos
de la microplaca de 24 pocillos. Se pulieron los discos de cera con espátula de lecrón
y se alisaron con monómero y gasas. Todas las superficies internas de la mufla se
aislaron con petrolato para evitar que el yeso se adhiriera a ellas. Se vertió yeso
tipo iv en la parte inferior de la mufla, se colocaron discos de cera, previa aplicación
de petrolato en la superficie de los discos e introduciendo hasta la mitad del grosor
de éstos para evitar retenciones.
Después de que el yeso fraguó, se aisló la superficie de éste con separador yeso-yeso
y se inició una segunda fase de inclusión de yeso tipo IV cerrando con la mufla superior
y cubriendo los discos con el yeso. Una vez terminado el tiempo de fraguado del yeso,
se abrió la mufla y se retiraron los discos de cera. Se preparó PMMA termopolimerizable
colocando el monómero en un recipiente de vidrio y sobre éste se adicionó el polímero
en una relación de tres partes de polímero y una parte de monómero en volumen. El
recipiente permaneció cerrado hasta que el acrílico alcanzó el estado filamentoso,
entonces se colocó en la mufla, se cubrió con una lámina de polietileno y se cerró
la mufla. La mufla se prensó en forma lenta hasta llegar a 1500 psi. Se descargó la
prensa, se destapó la mufla y se removió la película de polietileno, retirando el
excedente de acrílico. Se cerró nuevamente la mufla y se aplicó una presión definitiva
de 2000 psi. Después del prensado final y todavía bajo presión, se instalaron los
tornillos, hasta que éstos se apoyaron en la superficie de la mufla.
El horno de microondas que se empleó para la polimerización, debe tener una potencia
mínima de 800 watts y máxima de 1300 watts. Se colocó la mufla sobre el plato giratorio
dentro del horno, con los tornillos hacia abajo. En la primera fase, se programó el
horno 3 minutos a una potencia de 40%. En la segunda fase, se dejó 4 minutos con la
mufla dentro del horno apagado. En la tercera fase, se programó el horno 3 minutos
a la máxima potencia. Por último, se retiró la mufla del microondas y se colocó en
una tina con agua fría, durante 45 minutos. Posteriormente, se retiraron los tornillos
de la mufla y se separan cuidadosamente la mufla de la contramufla. Se eliminaron
las irregularidades de la muestra dejando una superficie lisa y tersa con ayuda de
lijas de agua grano fino.
Recubrimiento del acrílico termopolimerizable (PMMA) con nanopartículas de cobre
Los discos de acrílico se colocaron en el Spin Coater (Holmarc Opto-mechanics, modelo
HO-TH-05, Kalamassery, India) y se recubrieron con 40μl de Cu NPS a diferentes concentraciones
(31.5, 15.75, 7.875, 3.9375 y 0 μg). Se inició dicho recubrimiento colocando 40 μl
de la solución de las nanopartículas con el dispositivo funcionando a 1500 rpm por
15 s y, posteriormente, a 1200 rpm por otros 15 s. Por último, se colocaron los discos
en el horno a 60 ºC por 60 s.
Evaluación de la inhibición bacteriana en acrílico termopolimerizable (PMMA) con nanopartículas
de cobre
Los experimentos sobre la actividad antimicrobiana se llevaron a cabo según lo descrito
por el Instituto de Estándares Clínicos y de Laboratorio (CLSI) (Wikler 2009). La inhibición bacteriana de las Cu NPS en los discos de acrílico termopolimerizable
(PMMA) se probó contra las bacterias patógenas humanas Staphylococcus aureus, Escherichia coli y Enterococcus faecalis determinando la concentración inhibitoria mínima (MIC) y la concentración bactericida
mínima (MBC) siguiendo el método de dilución en caldo. En una microplaca de 24 pocillos
se colocaron los discos de acrílico con recubrimiento a diferentes concentraciones
de Cu NPS, discos de acrílico sin recubrimiento, controles positivo y negativo, cada
una por triplicado.
En cada pocillo se adicionó 1 mL caldo Mueller-Hinton. Previamente se habían empleado
medios selectivos para cultivar cada cepa y después cada una se cultivó en medio no
selectivo y se incubó a 37 ºC durante 24 h, el día previo al experimento, para obtener
cultivos bacterianos frescos, los cuales se usaron para preparar el respectivo patrón
de McFarland de cada cepa bacteriana. Cada patrón de McFarland se diluyó en relación
1:20 utilizando solución salina al 8%. Después de la colocación de los discos en cada
pocillo se inoculó cada uno asépticamente con la respectiva suspensión bacteriana
(la concentración final fue de aproximadamente 5 × 105 CFU/ml). Una vez inoculada, la microplaca se incubó a 37 ºC durante 24 h, en una
incubadora con agitación a 200 rpm. Se traspasaron 100 μl de la solución de cada uno
de los pocillos a una caja de 96 pocillos y se agregaron 100 μl de MTT (0.0002 g/ml)
disuelto en pbs en cada pocillo, se incubó la placa durante 4 h y se adicionaron 100
μl de DMSO en cada pocillo. La presencia o ausencia de turbidez en cada pocillo se
observó mediante el método MTT. La densidad óptica se leyó en un lector de microplaca
(Thermo Scientific, St. Luis, MO, EUA) a 595 nm.
Los resultados se expresaron como porcentaje de las bacterias viables en comparación
con los controles no tratados. La concentración mínima de los pocillos que no mostraron
turbidez (ausencia a simple vista de los cristales de formazano) se registró como
MIC, para cada cepa bacteriana. El MBC se identificó mediante la determinación de
la concentración más baja de agente antibacteriano que reduce la viabilidad del inóculo
bacteriano inicial por ≥ 99.9% o ≥ 3 log de reducción del recuento de inóculo. Para
esto, se subcultivaron los pocillos en placas de agar Mueller-Hinton para corroborar
los datos obtenidos a partir de la lectura de la densidad óptica antes mencionada.
Evaluación de la adhesión bacteriana en acrílico termopolimerizable (PMMA) con nanopartículas
de cobre
Se realizaron experimentos de adhesión bacteriana utilizando cepas dos bacterianas
gram-positivas (S. aureus y E. faecalis) y una cepa gram-negativa (E. coli). La prueba de adhesión bacteriana se realizó como sigue: en una caja de 24 pocillos,
se colocaron 6 ml de caldo nutriente Mueller-Hinton en cada uno de los pocillos. Posteriormente
se inocularon los pocillos con la respectiva cepa bacteriana a una concentración equivalente
a 0.5 de McFarland, es decir, de 1 × 108 CFU/mL. A continuación, los especímenes (discos de PMMA con nanopartículas de cobre
a diferentes concentraciones, así como los controles de PMMA sin nanopartículas) se
colocaron en los pocillos. Después de 24 h de incubación a 37 ºC bajo agitación continua
a 100 rpm, se retiraron cuidadosamente los especímenes del medio, las bacterias adheridas
se lavaron con pbs para retirar a aquellas bacterias que se encuentran no adheridas
a los especímenes. Las bacterias adheridas a cada disco de PMMA se removieron con
hisopos estériles y se cuantificaron mediante subcultivos de 100 μl a una placa de
agar Mueller-Hinton y se contaron las bacterias supervivientes después de 24 h de
cultivo a 37 ºC como cfu. Cada experimento se repitió por triplicado.
Evaluación de la citotoxicidad en acrílico termopolimerizable (PMMA) con nanopartículas
de cobre
Cultivo celular. Se subcultivaron fibroblastos gingivales humanos (HGF) en su división celular número
8 en un plato de 10 cm con α-MEM, FBS, penicilina 100 UI/mL, estreptomicina 100 mg/ml
y 1% de Glutamax. Las células se recogieron después mediante tratamiento con tripsina
al 0.25%, EDTA-2Na en PBS(-). Ensayo de actividad citotóxica. Se inocularon células HGF (2 × 105 células/ml) en cada pocillo de una microplaca
de 24 pocillos y se incubaron durante 48 h para conseguir la adherencia y proliferación
celular completa. En cada pocillo se colocan los discos de acrílico con recubrimiento
a diferentes concentraciones de Cu NPS, discos de acrílico sin recubrimiento, controles
positivo y negativo, cada uno por triplicado, se incubó por 24 h. El porcentaje de
células viables se determinó mediante el método MTT. Este método consiste en reemplazar
el medio de cultivo con MTT (0.2 mg / ml) disuelto en DMEM y las células se incubaron
durante 4 h a 37 ºC. Después de sustituir el medio, el producto de formazano se disolvió
con DMSO. Las células viables permanecen en el fondo de los pocillos, por lo que el
sobrenadante se separa y se lava tres veces, después se realizan las lecturas de los
pocillos a una absorbancia óptica de 570 nm usando un lector de microplacas. Adicionalmente,
se obtuvieron imágenes en el microscopio óptico (Leica DMIL Led, Axi CAM MRC Zeiss,
Alemania). El grado de citotoxidad se clasificó de acuerdo con la iso 10993-5, Evaluación
biológica de dispositivos médicos, Parte 5: pruebas de citotoxicidad in vitro, la cual clasifica como no citotóxico (viabilidad celular superior al 75%), ligeramente
citotóxica (viabilidad celular que varía entre 50% y 75%), moderadamente citotóxica
(viabilidad celular que varía entre 25% y 50%) y severamente citotóxica (viabilidad
celular inferior a 25%).
Resultados y discusión
Caracterización
El cobre, conocido desde hace mucho tiempo por su actividad antibacteriana y por su
costo relativamente bajo, es un atractivo agente biocida (Camacho-Flores et al., 2015). El coste económico de las NPS de cobre es bajo en comparación con otros nanomateriales
metálicos como el oro y la plata. El uso práctico de las nanopartículas de Cu se enfrenta
a la principal dificultad que surge de su inestabilidad debido a la oxidación que
sufre en contacto con el ambiente. Además, la estabilidad coloidal de las nanopartículas
así como su solubilidad en agua son factores indispensables para su potencial uso
en aplicaciones biológicas. Por lo que el empleo de nanopartículas solubles en agua
es necesario para asegurar su solubilidad en este medio. En lo que respecta a la caracterización
de las nanopartículas de cobre, en la literatura se ha reportado que las nanopartículas
de cobre metálico tienen una banda de absorción centrada en 570 y 600 nm asignada
a la resonancia del plasmón superficial, pero debido a que el cobre se oxida fácilmente
en condiciones ambientales, las nanopartículas podrían presentar una monocapa de óxido
la cual puede ser identificada como una banda de absorción residual centrada en 800
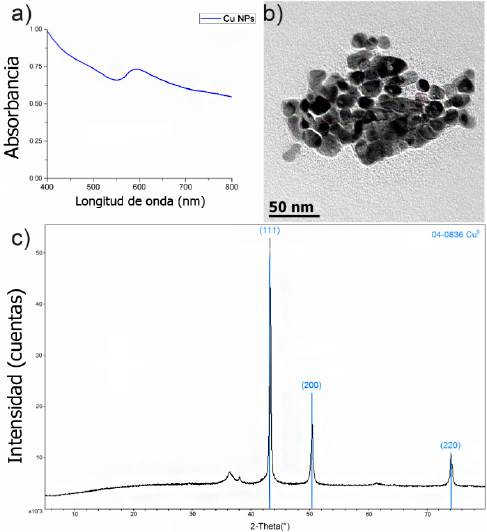
nm (Khanna et al., 2007; Zhang et al., 2010; Silvester et al., 1991). En la Figura 1, se observa un valor máximo en 593 nm, por lo que podemos concluir que se obtuvieron
nanopartículas de cobre metálico y que el surfactante utilizado evitó la oxidación,
ya que no se observa la banda de 800 nm correspondiente al óxido de cobre.
Figura 1
a) Espectro Uv-vis de las nanopartículas de cobre. b) Micrografía de TEM en donde
se aprecia la morfología y tamaño de las Cu NPS sintetizadas. c) Difractograma de
las nanopartículas de cobre.
Fuente: Elaboración de los autores.
En la Figura 1b), se muestra la micrografía del producto de la síntesis de las nanopartículas de
cobre recubiertas con el citrato, se distingue que las nanopartículas tiene una morfología
similar y una distribución de tamaño uniforme. Se observa un aglomerado de nanopartículas
poliedrales, las cuales presentan un tamaño promedio de menor a 20 nm.
En la Figura 1c) se muestra el patrón de difracción obtenido, los picos de difracción indexados (111),
(200) y (220), indican la presencia de cobre metálico, al ser comparados con la tarjeta
cristalográfica JCPDS 04-0836.
Evaluación de la inhibición bacteriana en acrílico termopolimerizable (PMMA) con nanopartículas
de cobre
Las nanopartículas metálicas pueden incorporarse en la superficie de un polímero o
incorporarse a la matriz. En particular, las nanopartículas de cobre han sido impregnadas
en la superficie de fibras de algodón, látex y otros materiales poliméricos (Borkow y Gabbay, 2005).
Los resultados de este estudio pueden observarse en la Figura 2, donde hay un efecto de inhibición del crecimiento bacteriano sobre las bacterias
en estudio al estar en contacto con las nanopartículas de cobre sobre los discos de
PMMA. En diversos estudios se ha mostrado que las técnicas actuales para procesar
bases acrílicas para dentaduras producen cierto grado de porosidades, las cuales permiten
la colonización bacteriana (Lee, Lee y Nam, 2008). Una forma de abordar este problema es cubriendo la superficie de PMMA con nanomateriales
que exhiban un efecto antimicrobiano. Desde la introducción de agentes antimicrobianos
basados en nanopartículas, éstos han generado un gran interés (García-Contreras et al., 2011). Se han discutido diversos mecanismos para explicar la actividad de los materiales
nanoestructurados, como la liberación de iones desde la superficie de las nanopartículas,
la internalización a través de la pared celular, la producción de especies reactivas
de oxígeno y el daño estructural a la membrana debido a vértices presentes en la morfología
de las nanoestructuras (Lemire, Harrison y Turner, 2013; Fu et al., 2014; Mandal, 2016; Van Dong, Ha y Kasbohm, 2012). Por lo que resulta crucial la búsqueda de superficies que cuenten con efecto de
inhibición bacteriana. A la máxima concentración de estudio, que fue 31.5 μg por disco
de PMMA, se encontró una reducción del crecimiento bacteriano de 99.9%, 99.8% y 91.3%
para S. aureus, E. coli y E. faecalis, respectivamente, lo que indica que existe una inhibición bacteriana considerable.
En este estudio se emplearon S. aureus y E. coli como referentes para bacterias gram positivas y gram negativas, respectivamente.
Figura 2
Gráfico de la inhibición del crecimiento bacteriano al estar en contacto con las nanopartículas
de cobre sobre PMMA a diferentes concentraciones.
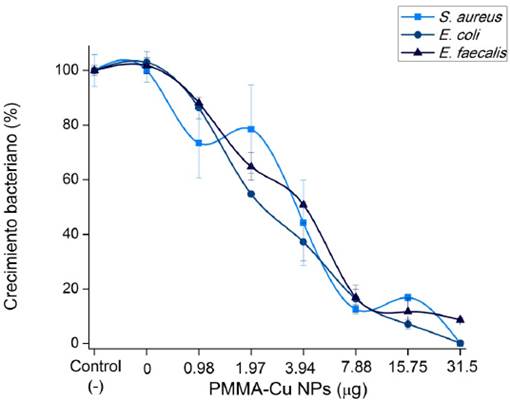
Fuente: Elaboración de los autores.
Se observa en el presente estudio al igual que los resultados de otros reportes en
la literatura que las bacterias gram positivas resultan más sensibles en comparación
con las gram negativas a la acción de las nanopartículas, lo cual es atribuible al
tipo de membrana. Mientras que las bacterias gram negativas presentan dos membranas
lipídicas entre las que se localiza una fina pared celular de peptidoglicano, las
bacterias gram positivas presentan una única membrana lipídica, siendo la pared de
peptidoglicano mucho más gruesa. Sin embargo, la bacteria que se empleó por su resistencia
a muchos agentes antibióticos fue E. faecalis. Dicha bacteria se caracteriza por resistir condiciones consideradas extremas, como
ser capaz de sobrevivir en un medio con un pH de hasta 11 (McHugh et al., 2004). Por lo que el efecto de la inhibición bacteriana alcanzada en este estudio fue
menor que en las dos bacterias mencionadas anteriormente; por lo tanto, para E. faecalis, el efecto del PMMA-Cu NPS puede considerarse bacteriostático. En otros estudios
se ha reportado el uso de nanopartículas metálicas para proporcionar al PMMA un efecto
antimicrobiano. Se ha determinado la inhibición bacteriana de PMMA-Cu NPS inmovilizadas
con bentonita para S. aureus (ATCC 25123), y los autores concluyeron que este material exhibe un efecto bacteriostático
para la cepa en estudio (Weickmann et al., 2005). Además se ha desarrollado un material de PMMA-dióxido de titanio (TiO2) con actividad antibacteriana, para la fabricación de prótesis dentales impresas
en 3D (Totu et al., 2017). Al parecer, el PMMA-TiO2 (preparado por sol-gel) presenta un efecto antibacteriano fotoinducido para la reducción
en el crecimiento bacteriano bajo la luz natural interior, pues casi el 100% de S. aureus y E. coli, se inactivaron con 2 horas de iluminación. En comparación con el PMMA sin ningún
tratamiento, también se demuestra la capacidad superior de antiadhesión de la superficie
de PMMA-TiO2. (Su et al., 2010). Otras nanopartículas de óxido metálico que también se han utilizado para su integración
a PMMA son las nanopartículas de dióxido de hierro. Estas nanopartículas mejoraron
las propiedades antimicrobianas y mecánicas de las resinas acrílicas (Acosta-Torres et al., 2014). También se ha demostrado que la incorporación de nanopartículas en el PMMA resulta
en un material biocompatible y que presenta buenas propiedades físicas y mecánicas
(Moreno-Maldonado et al., 2012).
Evaluación de la adhesión bacteriana en acrílico termopolimerizable (PMMA) con nanopartículas
de cobre
Se encontró que existe una disminución de la adhesión bacteriana de las cepas en estudio
a la superficie de PMMA con nanopartículas cobre que es dosis-dependiente, es decir,
que a mayor concentración de las nanopartículas en sobre la superficie de PMMA - menor
es la adhesión de las bacterias. (Figura 3). S. aureus fue la bacteria que presentó una mayor disminución en la adherencia sobre el PMMA-Cu
NPS, mientras que E. coli y E. faecalis solamente no presentaron adherencia bacteriana a la concentración más alta (31.5
μg por disco).
Figura 3
Imágenes de los subcultivos que muestran la inhibición de la adhesión bacteriana al
estar en contacto con nanopartículas de cobre la superficie de los discos de PMMA
a diferentes concentraciones.
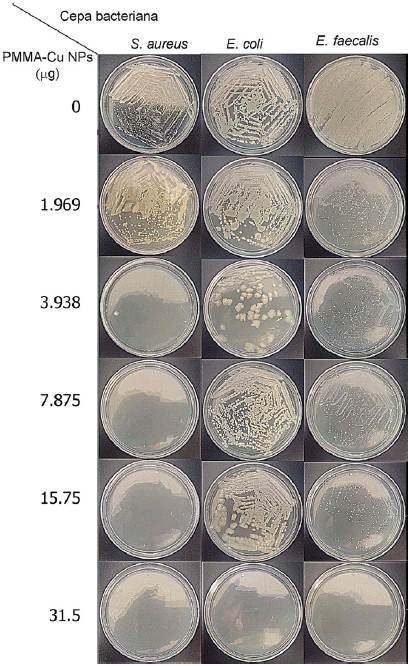
En otros estudios previos, se ha observado que la adherencia de Candida albicans se redujo significativamente en el grupo de PMMA con nanopartículas de plata en comparación
del PMMA sin nanopartículas (Acosta- Torres et al., 2012). Además del efecto a través de los mecanismos antibacteriales propios de
las nanopartículas, es posible que al colocarse las nanopartículas sobre la superficie
del PMMA éstas ocupen los espacios de formados por las porosidades propias del procesamiento
de este polímero. Dicho efecto físico a través de la reducción de la rugosidad sobre
la superficie del PMMA también es posible que prevenga la adhesión bacteriana Fuente:
Elaboración de los autores. (Acosta-Torres et al., 2011).
Evaluación de la citotoxicidad en acrílico termopolimerizable (PMMA) con nanopartículas
de cobre
En la Figura 4 puede observarse la viabilidad celular en los discos de acrílico termopolimerizable
(PMMA). De acuerdo con la Norma ISO I10993-5 resultando que el PMMA sin nanopartículas,
a las 24 horas, presenta una viabilidad superior al 75%, por lo que se considera no
citotóxico, sin embargo, a las 48, 72 y 96 h muestra una citotoxicidad ligera (viabilidad
celular menor a 75%). En general, a las 24 horas, se observa una citotoxicidad de
ligera a moderada para las dos concentraciones más altas de nanopartículas sobre PMMA.
Sin embargo, es evidente que la citotoxicidad aumenta conforme se incrementan los
intervalos de tiempo. También se observa que, mientras mayor es la concentración de
las nanopartículas, la viabilidad celular decrece, por lo tanto exhiben un comportamiento
dosis-dependiente.
Figura 4
Gráfico de citotoxicidad de las nanopartículas de cobre en fibroblastos gingivales
humanos (HGF) a diferentes intervalos de tiempo.
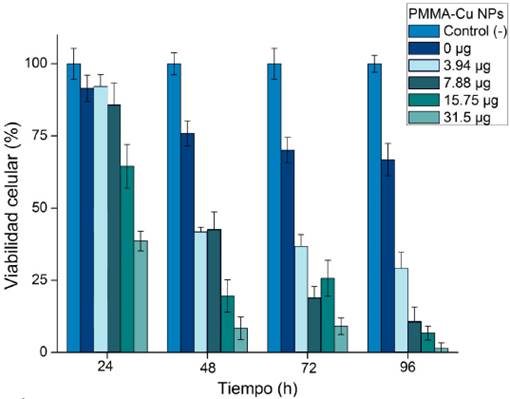
Fuente: Elaboración de los autores.
Se observa en las imágenes de microscopía óptica la viabilidad de hgf a intervalos
de 24, 48, 72 y 96 h en función de la concentración del recubrimiento de las nanopartículas
de cobre en los discos de PMMA (Figura 5). Las bases para dentaduras formadas por resina acrílica de PMMA, que están en contacto
con la mucosa oral del paciente, es un aspecto crítico para la biocompatibilidad en
contacto con los tejidos, por lo cual resulta importante conocer el grado de citotoxicidad.
Figura 5
Imágenes de microscopia óptica a una magnificación de 200x. Se observa la viabilidad
de HGF a intervalos de 24, 48, 72 y 96 h en función de la concentración del recubrimiento
de las Cu NPS en los discos de acrílico termopolimerizable (PMMA). La barra de escala
en cada imagen representa 5 µm.
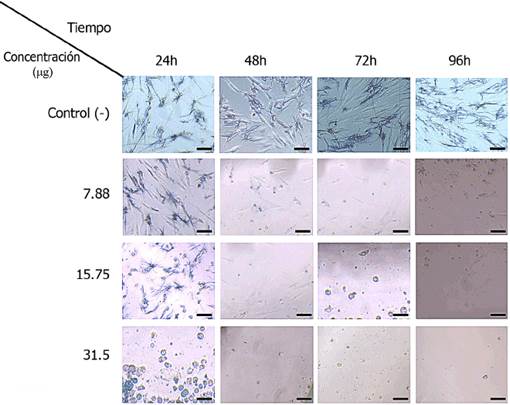
Fuente: Elaboración de los autores.
La citotoxicidad de PMMA se correlaciona con los métodos de polimerización, la temperatura,
el ciclo de polimerización y el tiempo de almacenamiento de la resina acrílica puede
influir en la cantidad de monómero residual y la citotoxicidad del material. El PMMA
termopolimerizable en sí, presenta un cierto grado de citotoxicidad (Neves et al., 2013) lo cual concuerda con los resultados del presente estudio.
Conclusiones
Bajo las condiciones de este estudio, puede concluirse que la incorporación de nanopartículas
de cobre en la superficie del PMMA termopolimerizable mejora sus propiedades a través
de la inhibición del crecimiento bacteriano y la inhibición de la adhesión bacteriana
en su superficie. El PMMA sin nanopartículas mostró una disminución en la viabilidad
celular, la cual aumenta en función del tiempo de exposición. La citotoxidad que exhibió
el PMMA enriquecido con nanopartículas de cobre exhibió una citotoxicidad dosis-dependiente,
la cual también se incrementa en función del tiempo de exposición.




